Oxit bazơ không tác dụng với nước ở điều kiện thường là:
A. BaO
B.
C. CaO
D. MgO
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án D
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Oxit A tác dụng với nước tạo axit nitric. Xác định A, biết , trong A có 2 nguyên tử nitơ
Cho mẩu Na vào nước thấy có 4,48(l) khí bay lên. Tính khối lượng Na đã tham gia phản ứng?
I. Thành phần hóa học
1. Sự phân hủy nước
- Khi tiến hành điện phân nước bằng dòng điện một chiều, trên bề mặt hai điện cực sinh ra khí hiđro và oxi với tỉ lệ thể tích là 2:1.
- Phương trình hóa học:
2H2O 2H2↑ + O2↑
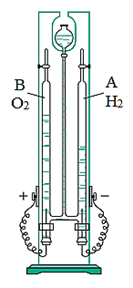
Hình 1: Phân hủy nước bằng dòng điện
2. Sự tổng hợp nước
Thí nghiệm: Cho nước vào đầy ống thủy tinh hình trụ. Cho vào ống lần lượt 2 thể tích khí hiđro và 2 thể tích khí oxi.
→ Mực nước trong ống ở vạch số 4.
Đốt bằng tia lửa điện hỗn hợp khí, ta thấy sau cùng hỗn hợp chỉ còn 1 thể tích oxi. Vậy 1 thể tích oxi đã hóa hợp với 2 thể tích hiđro tạo thành nước.
Phương trình hóa học:
2H2 + O2 2H2O
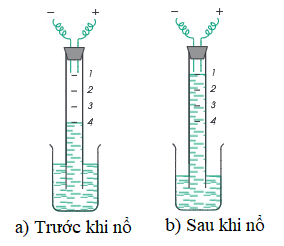
Hình 2: Tổng hợp nước
Kết luận:
- Nước là hợp chất tạo bởi 2 nguyên tố oxi và hiđro. Chúng đã hóa hợp với nhau
- Bằng thực nghiệm, người ta tìm được công thức hóa học của nước là H2O.
II. Tính chất của nước
1. Tính chất vật lý
- Nước là chất lỏng không màu (tuy nhiên lớp nước dày có màu xanh da trời), không mùi, không vị, sôi ở 100°C (p = 760 mmHg), hóa rắn ở 0°C thành nước đá và tuyết.
- Khối lượng riêng ở 4°C là 1 g/ml (hay 1kg/lít).
- Nước có thể hòa tan được nhiều chất rắn (muối ăn, đường,…), chất lỏng (cồn, axit,...), chất khí (HCl, NH3,…)
2. Tính chất hóa học
a) Tác dụng với kim loại: Nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Na, Ca, Ba, K,…
Phương trình hóa học:
2Na + 2H2O → 2NaOH + H2↑
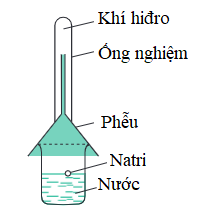
Hình 3: Phản ứng của nước với natri
b) Tác dụng với một số oxit bazơ như CaO, K2O,… tạo ra bazơ tương ứng Ca(OH)2, KOH,…
- Dung dịch bazơ làm quỳ tím chuyển xanh.
Phương trình hóa học:
K2O + H2O → 2KOH
c) Tác dụng với một số oxit axit như SO3, P2O5,… tạo thành axit tương ứng H2SO4, H3PO4,…
- Dung dịch axit làm quỳ tím chuyển đỏ.
Phương trình hóa học:
SO3 + H2O → H2SO4
III. Vai trò của nước và cách chống ô nhiễm nguồn nước:
- Vai trò của nước trong đời sống và sản xuất:
+ Hòa tan chất dinh dưỡng cho cơ thể sống

Hình 4: Dịch truyền tĩnh mạch glucose 5%
+ Tham gia vào quá trình hóa học trong cơ thể người và động vật.
+ Tham gia quá trình quang hợp của cây xanh
6CO2 + 6H2O C6H12O6 + 6O2↑
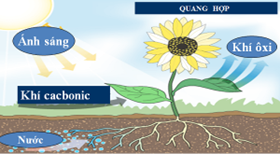
Hình 5: Mô hình quang hợp của cây xanh
+ Có vai trò rất quan trọng trong đời sống: sản xuất công nghiệp, nông nghiệp, giao thông vận tải,…

Hình 6: Một số ứng dụng của nước trong sản xuất, chăn nuôi
- Cách chống ô nhiễm nguồn nước:
+ Không vứt rác thải xuống nguồn nước.
+ Xử lý nước thải trước khi cho nước thải chảy vào sông, hồ, biển.
- Lượng nước ngọt là rất nhỏ so với lượng nước trên Trái Đất. Nhiều nguồn nước ngọt đang bị ô nhiễm nặng do đó cần phải sử dụng tiết kiệm nước.