Một bình điện phân chứa dung dịch muối niken với hai điện cực bằng niken. Biết đương lượng điện hoá của niken là và khối lượng niken bám vào catot trong 1 giờ khi cho dòng điện có cường độ I chạy qua bình này là 5,4g. Cường độ dòng điện chạy qua bình bằng
A. 0,5A
B. 5A
C. 15A
D. 1,5A
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án: B
Cường độ dòng điện chạy qua bình bằng:
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Một bình điện phân chứa dung dịch bạc nitrat () có anot bằng bạc. Biết bạc (Ag) có khối lượng mol nguyên tử A = 108g/mol và hoá trị n = 1. Nếu hiệu điện thế giữa hai cực của bình là 10V và sau 16 phút 5 giây có 4,32g bạc bám vào anot thì điện trở của bình là
Một bình điện phân chứa dung dịch đồng sunphat ( ) có anot bằng đồng. Biết khối lượng mol nguyên tử của đồng (Cu) là A = 63,5g/mol và hoá trị n = 2. Nếu cường độ dòng điện chạy qua bình này là 1,93A thì trong 0,5 giờ, khối lượng của catot tăng thêm là
Cho đương lượng điện hoá của niken là . Khi cho một điện lượng 10C chạy qua bình điện phân có anot làm bằng niken, thì khối lượng niken bám vào catot là:
Bình điện phân thứ nhất có anot bằng bạc nhúng trong dung dịch , bình điện phân thứ hai có anot bằng đồng nhúng trong dung dịch . Hai bình được mắc nối tiếp nhau vào một mạch điện. Sau 1,5 giờ, tổng khối lượng của hai catot tăng lên 2,1g. Cho biết ; ; ; . Khối lượng bạc bám vào bình thứ nhất và khối lượng m2 đồng bám vào bình thứ hai lần lượt là
Để mạ đồng hai mặt của một tấm sắt có diện tích mỗi mặt là , người ta dung nó làm catot của một bình điện phân có anot bằng đồng nhúng trong dung dịch rồi cho dòng điện có cường độ I = 1A chạy qua trong thời gian 1 giờ 20 phút. Biết , và khối lượng riêng của đồng là . Bề dày của lớp mạ là
Một bộ nguồn điện gồm 30 pin mắc thành ba nhóm nối tiếp, mỗi nhóm có 10 pin mắc song song; mỗi pin có suất điện động và điện trở trong . Mắc một bình điện phân đựng dung dịch có điện trở vào hai cực của bộ nguồn nói trên. Biết anot của bình điện phân bằng đồng và sau 50 phút có 0,013g đồng bám vào catot. Suất điện động bằng
I. Thuyết điện li
Trong dung dịch, các hợp chất hóa học như axit, bazơ và muối bị phân li (một phần hoặc toàn bộ) thành các nguyên tử (hoặc nhóm nguyên tử) tích điện gọi là ion; ion có thể chuyển động tự do trong dung dịch và trở thành hạt tải điện.
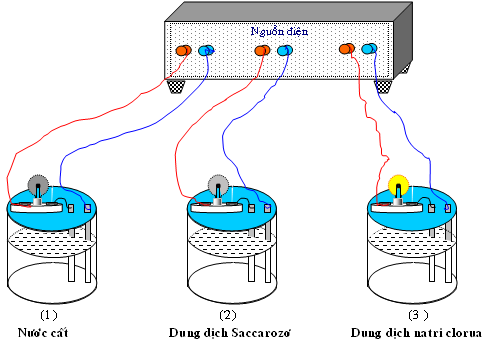
Các ion dương và âm vốn đã tồn tại sẵn trong các phân tử axit, bazo và muối. Chúng liên kết với nhau bằng lực Culong. Khi tan vào dung môi khác thì lực Culong yếu đi và một số phân tử bị chuyển động nhiệt tách thành các ion tự do.
Như vậy: những dung dịch và chất nóng chảy này được gọi là chất điện phân.
II. Bản chất dòng điện trong chất điện phân
- Dòng điện trong lòng chất điện phân là dòng ion dương và ion âm chuyển động có hướng theo hai chiều ngược nhau.
+ Ion dương chạy về phía catot nên gọi là cation.
+ Ion âm chạy về phía anot nên gọi là anion.
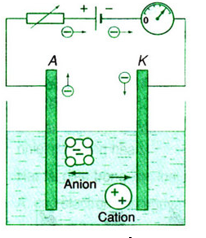
Chiều của các hạt tải điện trong chất điện phân
- Chất điện phân không dẫn điện tốt bằng kim loại. Do mật độ ion trong chất điện phân thường nhỏ hơn mật độ electron tự do trong kim loại, đồng thời khối lượng và kích thước của ion lớn hơn electron tự do nên tốc độ của chuyển động có hướng của chúng nhỏ hơn, môi trường dung dịch mất trật tự nên cản trở chuyển động mạnh.
- Dòng điện trong chất điện phân không chỉ tải điện lượng mà còn tải cả vật chất đi theo. Tới điện cực chỉ có các electron có thể đi tiếp, còn lượng vật chất đọng lại ở điện cực, gây ra hiện tượng điện phân.
III. Các hiện tượng diễn ra ở điện cực. Hiện tượng dương cực tan
Ta xét bình điện phân dung dịch có điện cực bằng đồng.
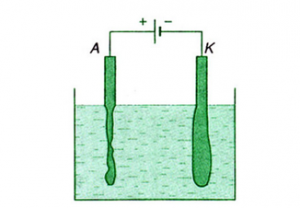
- Khi dòng điện chạy qua, cation chạy về catôt, về nhận electron từ nguồn điện đi tới. Ta có ở các điện cực:
+ Ở catôt: + → Cu
+ Ở anôt: Cu → +
- Khi anion chạy về anôt, nó kéo ion vào dung dịch. Như vậy, đồng ở anôt sẽ tan dần vào trong dung dịch.
Kết luận: Hiện tượng dương cực tan xảy ra khi các anion đi tới anot kéo các ion kim loại của điện cực vào trong dung dịch.
IV. Các định luật Fa-ra-đây
1. Định luật Fa-ra-đây thứ nhất
Khối lượng vật chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện trường chạy qua bình đó: m = k.q
Trong đó k gọi là đương lượng điện hóa của chất được giải phóng ở điện cực.
2. Định luật Fa-ra-đây thứ hai
Đương lượng điện hóa k của một nguyên tố tỉ lệ với đương lượng gam của nguyên tố đó. Hệ số tỉ lệ là , trong đó F gọi là số Fa-ra-đây.
Kết hợp hai định luật Fa-ra-đây, ta được công thức Fa-ra-đây:
Trong đó:
+ F = 96500 C/mol
+ A là khối lượng mol (g/mol)
+ n là hóa trị
+ m là khối lượng chất được giải phóng ở điện cực (g)
+ I là cường độ dòng điện (A)
+ t là thời gian dòng điện chạy qua (s)
V. Ứng dụng của hiện tượng điện phân
Hiện tượng điện phân có nhiều ứng dụng trong thực tế sản xuất và đời sống như luyện nhôm, tinh luyện đồng, điều chế clo, xút, mạ điện, đúc điện…
1. Luyện nhôm
Công nghệ luyện nhôm chủ yếu dựa vào hiện tượng điện phân quặng nhôm nóng chảy.
+ Quặng nhôm phổ biến là bôxit giàu nhôm ôxit . Nhiệt độ nóng chảy của rất cao nên người ta pha thêm vào quặng để hạ nhiệt nóng chảy xuống còn . Bể điện phân có cực dương là quặng nhôm nóng chảy, cực âm bằng than, chất điện phân là muối nhôm nóng chảy, dòng điện chạy qua khoảng .

Công nghiệp luyện nhôm
2. Mạ điện
Bể điện phân lúc này gọi là bể mạ có anot là một tấm kim loại để mạ, catot là vật cần mạ.
Chất điện phân thường là dung dịch muối kim loại để mạ (nếu mạ niken ta dùng tan trong nước,…) thêm một số chất phụ gia để lớp mạ bám chắc, bền đẹp hơn. Dòng điện qua bể mạ được chọn một cách thích hợp để đảm bảo chất lượng của lớp mạ.


Mạ điện