Cho 28 gam Fe vào dung dịch chứa 1,3 mol H2SO4 đặc nóng (giả thiết SO2 là sản phẩm khử duy nhất). Sau khi các phản ứng xảy ra hoàn toàn thu được
A. 0,15 mol FeSO4 và 0,2 mol Fe2(SO4)3
B. 0,2 mol FeSO4 và 0,15 mol Fe2(SO4)3
C. 0,5 mol FeSO4
D. 0,2 mol Fe2(SO4)3 và 0,1 mol Fe dư
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án B
nFe = 0,5 mol
Giả sử Fe tạo 2 muối FeSO4 ( x mol) và Fe2(SO4)3 (y mol)
Bảo toàn Fe: x + 2y = 0,5(1)
ne nhận = ne cho = 2x + 2.3y = 2x + 6y
Bảo toàn nguyên tố S: nH2SO4 = nSO4 + nSO2 => 1,3 = x + 3y + x + 3y(2)
Từ (1) và (2) => x = 0,2; y = 0,15
Vậy sau phản ứng thu được 0,2 mol FeSO4 và 0,15 mol Fe2(SO4)3
Chú ý
Lỗi sai thường gặp
+ chọn nhầm A vì nhầm lẫn số mol
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Cho 6,72 gam Fe phản ứng với 125 ml dung dịch HNO3 3,2M thu được dung dịch X và khí NO (sản phẩm khử duy nhất của N+5). Biết các phản ứng xảy ra hoàn toàn, khối lượng muối trong dung dịch X là
Cho các phát biểu sau:
1, Các nguyên tố nhóm B đều là kim loại
2, Kim loại trừ Hg thì ở điều kiện thường đều tồn tại ở trạng thái rắn.
3, Kim loại chiếm hơn 80% tổng số các nguyên tố trong bảng tuần hoàn.
4, Al dùng để làm dây tóc bóng đèn.
Số phát biểu đúng là
Cho 2,91 gam hỗn hợp X gồm Mg, Cu, Al tan hết trong dung dịch HNO3 loãng, dư thu dược 1,12 lít khí NO ở đktc ( không còn sản phẩm khử khác) và dung dịch Y. Cho Y tác dụng với dung dịch NaOH thì thu được lượng kết tủa lớn nhất là m gam. Giá trị của m là
Cho m (gam) hỗn hợp Al, Mg tác dụng với dung dịch HCl dư thu được 12,32 lít khí (đktc). Mặt khác, cũng m (gam) hỗn hợp trên cho tác dụng với dung dịch NaOH dư thu được 6,72 lít khí (đktc). Tính giá trị của m?
Nung nóng 2,13 gam hỗn hợp X gồm 3 kim loại Mg, Zn và Al ở dạng bột với oxi thu được hỗn hợp Y gồm các oxit có khối lượng 3,33 gam. Thể tích dung dịch HCl 1M vừa đủ để phản ứng hết với Y là:
Để m gam hỗn hợp Mg, Al và Fe trong không khí, sau một thời gian thu được 37,4 gam hỗn hợp X chỉ chứa các oxit. Hòa tan hoàn toàn X vào dung dịch HCl dư, sau phản ứng cô cạn dung dịch, thu được 81,4 gam muối khan. Giá trị của m là
M là kim loại trong số các kim loại sau: Cu Ba, Zn, Mg. Dung dịch muối MCl2 phản ứng với dung dịch Na2CO3 hoặc Na2SO4 tạo kết tủa, nhưng không tạo kết tủa khi phản ứng với dung dịch NaOH. Kim loại M là
Hòa tan hoàn toàn 100 gam hỗn hợp X gồm Fe, Cu, Ag trong dung dịch HNO3 (dư). Kết thúc phản ứng thu được 13,44 lít (đktc) hỗn hợp khí Y gồm NO2, NO, N2O theo tỉ lệ số mol tương ứng là 3 : 2 : 1 và dung dịch Z (không chứa muối NH4NO3). Cô cạn dung dịch Z thu được m gam muối khan. Giá trị của m và số mol HNO3 đã phản ứng lần lượt là
Hoà tan hoàn toàn 8,862 gam hỗn hợp gồm Al và Mg vào dung dịch HNO3 loãng, thu được dung dịch X và 3,136 lít (ở đktc) hỗn hợp Y gồm hai khí không màu, trong đó có một khí hoá nâu trong không khí. Khối lượng của Y là 5,18 gam. Cho dung dịch NaOH (dư) vào X và đun nóng, không có khí mùi khai thoát ra. Phần trăm khối lượng của Al trong hỗn hợp ban đầu là
I. Vị trí của kim loại trong bảng tuần hoàn
Các nguyên tố hóa học được phân thành kim loại và phi kim. Trong bảng tuần hoàn nguyên tố kim loại có mặt ở:
- Nhóm IA (trừ hiđro), nhóm IIA: các kim loại này là những nguyên tố s.
- Nhóm IIIA (trừ B), một phần của các nhóm IVA, VA, VIA: các kim loại này là những nguyên tố p.
- Các nhóm B (từ IB đến VIIIB): các kim loại chuyển tiếp, chúng là những nguyên tố d.
- Họ lantan và actini (xếp riêng thành hai hàng ở cuối bảng): các kim loại thuộc hai họ này là những nguyên tố f.
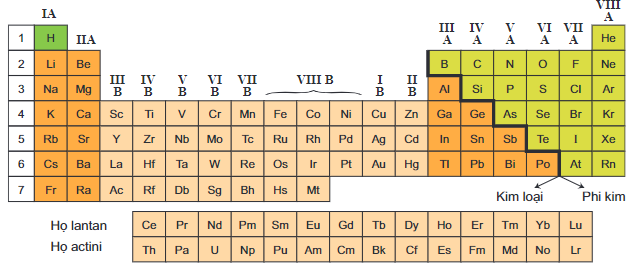
Vị trí của các nguyên tố kim loại trong bảng tuần hoàn
II. Cấu tạo của kim loại
1. Cấu tạo nguyên tử
- Nguyên tử của hầu hết các nguyên tố kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng.
Ví dụ:
+ Na: [Ne]3s1 có 1electron ở lớp ngoài cùng.
+ Mg: [Ne]3s2 có 2 electron ở lớp ngoài cùng.
+ Al: [Ne]3s23p1 có 3 electron ở lớp ngoài cùng.
- Trong chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với các nguyên tử của nguyên tố phi kim.
Ví dụ xét với chu kì 3:
|
Nguyên tử |
11Na |
12Mg |
13Al |
14Si |
15P |
16S |
17Cl |
|
rnt |
0,157 |
0,136 |
0,125 |
0,117 |
0,110 |
0,104 |
0,099 |
2. Cấu tạo tinh thể
- Ở nhiệt độ thường, trừ thủy ngân ở thể lỏng, còn các kim loại khác ở thể rắn, có cấu tạo tinh thể.
- Trong tinh thể kim loại, nguyên tử và ion kim loại nằm ở những nút mạng của tinh thể. Các electron hóa trị liên kết yếu với hạt nhân nên dễ tách ra khỏi nguyên tử và chuyển động tự do trong mạng tinh thể.
- Có ba kiểu mạng tinh thể kim loại đặc trưng là: lập phương tâm khối, lập phương tâm diện và lục phương.
a) Mạng tinh thể lục phương
- Đặc điểm: Các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt của hình lục giác đứng và ba nguyên tử, ion nằm phía trong của hình lục giác.
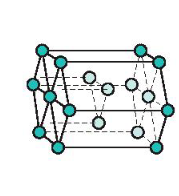
Mạng tinh thể lục phương
- Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiểm 74%, còn lại 26% là không gian trống.
- Thuộc loại này có các kim loại: Be, Mg, Zn …
b) Mạng tinh thể lập phương tâm diện
- Đặc điểm: Các nguyên tử và ion kim loại nằm trên các đỉnh và tâm các mặt của hình lập phương.
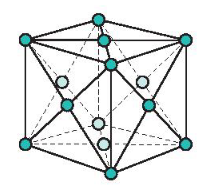
Mạng tinh thể lập phương tâm diện
- Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiểm 74%, còn lại 26% là không gian trống.
- Thuộc loại này có các kim loại: Cu, Ag, Au, Al …
c) Mạng tinh thể lập phương tâm khối
- Đặc điểm: Các nguyên tử và ion kim loại nằm trên các đỉnh và tâm của hình lập phương.
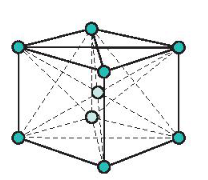
Mạng tinh thể lập phương tâm khối
- Trong tinh thể, thể tích của các nguyên tử và ion kim loại chỉ chiếm 68%, còn lại 32% là các không gian trống.
- Thuộc loại này có các kim loại: Li, Na, K, V, Mo …
3. Liên kết kim loại
Liên kết kim loại là liên kết được hình thành giữa nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.