Kim loại có những tính chất vật lý chung nào sau đây?
A. Tính dẻo, tính dẫn nhiệt, nhiệt độ nóng chảy cao
B. Tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim
C. Tính dẫn điện, tính dẫn nhiệt, có khối lượng riêng lớn, có ánh kim
D. Tính dẻo, có ánh kim, tính cứng
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án B
Kim loại có những tính chất vật lí chung là : tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim. Các tính chất vật lí này đều do electron tự do gây ra.
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Trong số các kim loại: nhôm, bạc, sắt, đồng, kim loại có tính dẫn điện tốt nhất là:
Cho dãy kim loại sau : Li, Ag, Al, Cr. Kim loại mềm nhất trong các kim loại trên là :
Cho dãy kim loại sau : Li, Ag, Al, Cr. Kim loại cứng nhất trong các kim loại trên là :
Tính chất vật lí nào sau đây không phải là tính chất vật lí chung của kim loại
Tính chất vật lý nào dưới đây của kim loại không phải do các electron tự do gây ra?
Trong bốn kim loại Al, Mg, Fe, Cu, kim loại có tính khử mạnh nhất là
Dãy nào dưới đây gồm các kim loại sắp xếp theo chiều tăng dần tính oxi hóa ?
Cho phản ứng hóa học : Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra
I. Tính chất vật lý
1. Tính chất chung
- Ở điều kiện thường, các kim loại đều ở trạng thái rắn (trừ Hg), có tính dẻo, dẫn điện, dẫn nhiệt và có ánh kim.
- Tính chất vật lý chung của kim loại gây nên bởi sự có mặt của electron tự do trong mạng tinh thể kim loại.
2. Giải thích
a) Tính dẻo
- Kim loại có tính dẻo: dễ rèn, dễ dát mỏng, dễ kéo sợi.
- Kim loại có tính dẻo là vì các ion dương trong tinh thể kim loại có thể trượt lên nhau dễ dàng mà không cần phải tách ra khỏi nhau nhờ những electron tự do chuyển động dính kết chúng với nhau.
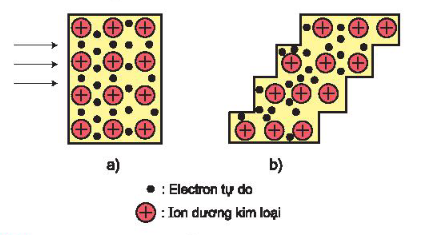
Các lớp mạng tinh thể kim loại trước khi biến dạng (a)
và sau khi biến dạng (b)
- Vàng là kim loại có tính dẻo cao, có thể dát thành lá mỏng đến mức ánh sáng có thể xuyên qua.
b) Tính dẫn điện
- Kim loại dẫn điện tốt nhất là Ag, sau đó đến Cu, Au, Al, Fe, …
- Ở nhiệt độ càng cao, tính dẫn điện của kim loại càng giảm do nhiệt độ cao các ion dương dao động càng mạnh cản trở dòng electron chuyển động.
c) Tính dẫn nhiệt
- Thường các kim loại dẫn điện tốt cũng dẫn nhiệt tốt.
- Các electron trong vùng nhiệt độ cao có động năng lớn, chuyển động hỗn loạn và nhanh chóng sang vùng có nhiệt độ thấp hơn, truyền năng lượng cho các ion dương ở vùng này nên nhiệt lan truyền được từ vùng này sang vùng khác trong khối kim loại.
d) Ánh kim
Các electron tự do trong tinh thể kim loại phản xạ hầu hết các tia sáng nhìn thấy được, đo đó kim loại có vẻ sáng lấp lánh gọi là ánh kim.

Trang sức kim loại bạc
3. Một số tính chất vật lí riêng:
a. Khối lượng riêng của các kim loại rất khác nhau nhưng thường dao động từ 0,5 g/cm3 (Li) đến 22,6 g/ cm3 (Os). Thường thì:
+ D < 5 g/cm3: kim loại nhẹ (ví dụ: K, Na, Mg, Al …).
+ D > 5 g/cm3: kim loại nặng (ví dụ: Zn, Fe...).
b. Nhiệt độ nóng chảy: biến đổi từ -39oC (Hg) đến 3410oC (W). Thường thì:
+ tnc < 1000oC: kim loại dễ nóng chảy.
+ tnc > 1500oC: kim loại khó nóng chảy (kim loại chịu nhiệt).
c. Tính cứng: Kim loại mềm nhất là K, Rb, Cs (dùng dao cắt được) và cứng nhất là Cr (cắt được kính).
II. Tính chất hóa học
Tính chất đặc trưng của kim loại là tính khử (nguyên tử kim loại dễ bị oxi hóa thành ion dương): M → Mn+ + ne
1. Tác dụng với phi kim
a) Tác dụng với clo
Hầu hết các kim loại đều có thể khử trực tiếp clo tạo thành muối clorua.
Ví dụ:
2Fe + 3Cl2 2FeCl3

Sắt tác dụng với clo
b) Tác dụng với oxi
Hầu hết các kim loại có thể khử oxi từ số oxi hóa 0 (O2) xuống số oxi hóa -2.
Ví dụ:
4Al + 3O2 2Al2O3
3Fe + 2O2 Fe3O4
c) Tác dụng với lưu huỳnh
Nhiều kim loại có thể khử lưu huỳnh từ số oxi hóa 0 xuống số oxi hóa -2. Phản ứng cần đun nóng (trừ Hg).
Hg + S → HgS
Fe + S FeS
2. Tác dụng với axit
a) Đối với dung dịch HCl, H2SO4 loãng:
(M đứng trước hiđro trong dãy thế điện cực chuẩn)
Ví dụ:
Mg + 2HCl → MgCl2 + H2
b) Đối với H2SO4 đặc, HNO3 (axit có tính oxi hóa mạnh):
+ Kim loại thể hiện nhiều số oxi hóa khác nhau khi phản ứng với H2SO4 đặc, HNO3 sẽ đạt số oxi hóa cao nhất.
+ Hầu hết các kim loại phản ứng được với HNO3 và H2SO4 đặc (trừ Pt, Au)
Khi đó trong H2SO4 bị khử thành (SO2); hoặc (H2S)
Trong HNO3 đặc bị khử thành (NO2)
Với HNO3 loãng có thể bị khử thành (NO) hoặc (N2O) hoặc (N2) hoặc (NH4+)
+ Các kim loại có tính khử càng mạnh thường cho sản phẩm khử có số oxi hóa càng thấp. Các kim loại như Na, K…sẽ gây nổ khi tiếp xúc với các dung dịch axit đặc.
Ví dụ:
2Fe + 6H2SO4 (đặc) Fe2(SO4)3 + 3SO2 + 6H2O
4Mg + 5H2SO4 (đặc) 4MgSO4 + H2S + 4H2O
Cu + 4HNO3 (đặc) Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 (loãng) 3Cu(NO3)2 + 2NO + 4H2O
Lưu ý: Fe, Al, Cr bị thụ động hóa trong H2SO4 đặc, nguội và HNO3 đặc, nguội.
3. Tác dụng với dung dịch muối
- Với Na, K, Ca và Ba…. (các kim loại tác dụng được với nước) phản ứng với nước trước sau đó dung dịch kiềm tạo thành sẽ phản ứng với muối.
Ví dụ: Cho Na vào dung dịch CuSO4
2Na + 2H2O → 2NaOH + H2
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
- Với các kim loại không tan trong nước, kim loại mạnh hơn khử được ion của kim loại yếu hơn trong dung dịch muối thành kim loại tự do.
Fe + CuSO4 → FeSO4 + Cu
Chú ý:
2Fe3+ + Fe → 3Fe2+
Cu + 2Fe3+ → Cu2+ + 2Fe2+
Fe2+ + Ag+ → Ag + Fe3+
4. Tác dụng với nước
- Các kim loại có tính khử mạnh: kim loại nhóm IA và IIA (trừ Be, Mg) khử H2O dễ dàng ở nhiệt độ thường.
- Các kim loại có tính khử trung bình chỉ khử nước ở nhiệt độ cao (Fe, Zn,…). Các kim loại còn lại không khử được H2O.
Ví dụ:
2Na + 2H2O → 2NaOH + H2
Ba + 2H2O → Ba(OH)2 + H2
III. Dãy điện hóa của kim loại
1. Cặp oxi hoá – khử của kim loại
Ag+ + 1e ⇄ Ag
Cu2+ + 2e ⇄ Cu
Mn+ + ne ⇄ M
[O] [K]
- Các nguyên tử kim loại (Ag, Cu, …) đóng vai trò là chất khử, các ion kim loại (Ag+, Cu2+…) đóng vai trò là chất oxi hóa.
- Dạng oxi hoá và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hoá – khử của kim loại.
Ví dụ: Cặp oxi hoá – khử Ag+/Ag; Cu2+/Cu; Fe2+/Fe
2. So sánh tính chất của các cặp oxi hoá – khử
Ví dụ: So sánh tính chất của hai cặp oxi hoá – khử Cu2+/Cu và Ag+/Ag.
Thực nghiệm cho thấy Cu tác dụng được với dung dịch muối AgNO3 theo phương trình:
Cu + 2Ag+→ Cu2+ + 2Ag
Kết luận:
Tính khử: Cu > Ag
Tính oxi hoá: Ag+ > Cu2+
3. Dãy điện hóa của kim loại
Người ta đã so sánh tính chất của nhiều cặp oxi hóa – khử và sắp xếp thành dãy điện hóa của kim loại:

4. Ý nghĩa về dãy điện hóa của kim loại
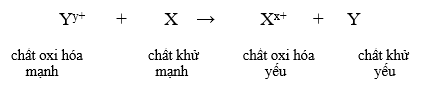
- Dãy điện hóa của kim loại cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hóa – khử theo quy tắc alpha (α): Phản ứng giữa hai cặp oxi hóa – khử sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.
- Cách xác định chiều của phản ứng oxi hóa – khử theo quy tắc alpha:
Tổng quát
Giả sử có hai cặp oxi hóa khử: Xx+/ X và Yy+/Y (trong đó cặp Xx+/ X đứng trước cặp Yy+/Y trong dãy điện hóa). Xác định chiều của phản ứng oxi hóa khử.
Bước 1: Viết hai cặp oxi hóa – khử theo đúng thứ tự trong dãy điện hóa:
Bước 2: Áp dụng quy tắc alpha (α)
Phản ứng xảy ra theo chiều mũi tên như sau:
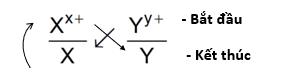
Bước 3: Xác định chiều phản ứng
Phản ứng xảy ra như sau:
Ví dụ: Xác định chiều phản ứng xảy ra giữa hai cặp Fe2+/ Fe và Cu2+/ Cu.
Hướng dẫn giải:
Bước 1: Theo trật tự dãy điện hóa có cặp Fe2+/ Fe đứng trước cặp Cu2+/ Cu.
Bước 2: Áp dụng quy tắc alpha:
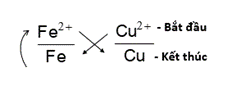
Bước 3: Xác định chiều phản ứng
Cu2+ + Fe → Cu + Fe2+
Phản ứng xảy ra theo chiều ion Cu2+ oxi hóa Fe để tạo ra Fe2+ và Cu.