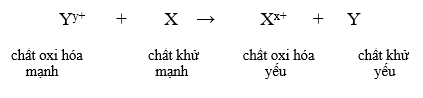
Cho các phản ứng xảy ra sau đây :
Dãy các ion được sắp xếp theo chiều giảm dần tính oxi hoá là:
A.
B.
C.
D.
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án C
→ tính oxi hóa của Ag+ > Fe3+
(2) Ni + 2HCl →NiCl2+ H2↑
→ tính oxi hóa của H+ > Ni2+
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Cho hỗn hợp gồm Zn, Mg và Ag vào dung dịch CuCl2, sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp gồm 3 kim loại. Ba kim loại đó là:
Cho 11,2 gam Fe vào 100 ml dung dịch AgNO3 5 M. Lắc kĩ cho phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là
Khi cho mẫu Zn vào bình đựng dung dịch X, thì thấy khối lượng chất rắn trong bình tăng lên. Dung dịch X là:
Ngâm bột sắt vào dung dịch gồm Cu(NO3)2 và AgNO3. Kết thúc phản ứng thu được dung dịch X gồm hai muối và chất rắn Y gồm hai kim loại. Dung dịch X gồm
Cho 4 kim loại Al, Fe, Mg, Cu và 4 dung dịch ZnSO4, AgNO3, CuCl2. Số kim loại khử được cả 3 dung dịch đã cho là
Nhúng thanh Fe vào dung dịch CuSO4. Sau một thời gian, khối lượng thanh sắt tăng 0,8 gam so với khối lượng ban đầu. Khối lượng Fe đã phản ứng là:
Cho 2,24 gam bột sắt vào 200 ml dung dịch CuSO4 0,05M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
Cho 2,7 gam Al tan hoàn toàn trong dung dịch HNO3 loãng, sau phản ứng thu được V lít khí N2O (đktc, sản phẩm khử duy nhất). Giá trị của V là
Kim loại nào sau đây khi tác dụng với HCl và tác dụng với Cl2 không cùng một loại muối clorua:
Kim loại không tác dụng với dung dịch H2SO4 loãng mà tác dụng với dung dịch H2SO4 đặc nguội là
Hoà tan hoàn toàn 8,48 gam hỗn hợp Mg và Fe trong dung dịch HCl dư thấy có 4,928 lít khí thoát ra (ở đktc) và dung dịch X. Cô cạn dung dịch X được bao nhiêu gam muối khan?
Kiến thức cần nắm vững
1. Cấu tạo của kim loại
a) Cấu tạo nguyên tử
Nguyên tử của hầu hết các nguyên tố kim loại có số electron lớp ngoài cùng ít (1, 2, 3e).
b) Cấu tạo tinh thể
Trong tinh thể kim loại, nguyên tử và ion kim loại nằm ở những nút mạng của tinh thể. Các electron hóa trị chuyển động tự do trong mạng tinh thể.
c) Liên kết kim loại
Liên kết kim loại là liên kết được hình thành giữa nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
2. Tính chất của kim loại
a) Tính chất vật lý chung
Các kim loại đều có tính dẻo, dẫn điện, dẫn nhiệt, có ánh kim do các electron tự do trong kim loại gây ra.
b) Tính chất hóa học:
- Các kim loại đều có tính khử: M → Mn+ + ne
- Nguyên nhân: Các electron hóa trị của nguyên tử kim loại liên kết yếu với hạt nhân nguyên tử, do đó các kim loại có khả năng nhường electron để tạo thành ion dương.
3. Dãy điện hoá của kim loại
- Người ta đã so sánh tính chất của nhiều cặp oxi hóa – khử và sắp xếp thành dãy điện hóa của kim loại:
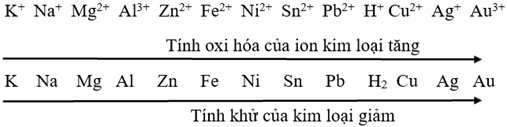
- Dãy điện hóa của kim loại cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hóa – khử theo quy tắc alpha (α): Phản ứng giữa hai cặp oxi hóa – khử sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.
- Cách xác định chiều của phản ứng oxi hóa – khử theo quy tắc alpha:
Tổng quát
Giả sử có hai cặp oxi hóa khử: Xx+/ X và Yy+/Y (trong đó cặp Xx+/ X đứng trước cặp Yy+/Y trong dãy điện hóa). Xác định chiều của phản ứng oxi hóa khử.
Bước 1: Viết hai cặp oxi hóa – khử theo đúng thứ tự trong dãy điện hóa:
Bước 2: Áp dụng quy tắc alpha (α)
Phản ứng xảy ra theo chiều mũi tên như sau:
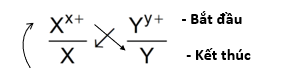
Bước 3: Xác định chiều phản ứng
Phản ứng xảy ra như sau: