Cation M+ có cấu hình electron ở lớp ngoài cùng là 2s22p6. M+ là cation nào sau đây?
A. Ag+
B. Cu+
C. Na+
D. K+
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án C
Cation M+ có cấu hình electron ở lớp ngoài cùng là 2s22p6 => cấu hình e của M là: 1s22s22p63s1
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Đặc điểm nào sau đây không là đặc điểm chung cho các kim loại nhóm IA?
Tính chất nào nêu dưới đây là sai khi nói về 2 muối NaHCO3 và Na2CO3 ?
Kali nitrat được dùng làm phân bón và chế tạo thuốc nổ. Công thức của kali nitrat là?
Đun nóng dung dịch NaHCO3 sau đó để nguội rồi nhúng quỳ tím vào dung dịch thu được. Hiện tượng xảy ra là
Khi cho từ từ dung dịch HCl vào dung dịch Na2CO3 khuấy đều, hiện tượng xảy ra là
Dung dịch KHCO3 phản ứng với chất nào sau đây thu được kết tủa trắng?
A. Kim loại kiềm
I. Ví trí trong bảng tuần hoàn và cấu hình electron nguyên tử
- Kim loại kiềm thuộc nhóm IA của bảng tuần hoàn, gồm các nguyên tố: Liti (Li); natri (Na); kali (K); rubiđi (Rb); xesi (Cs) và franxi (Fr).
Trong đó Fr là nguyên tố phóng xạ.
- Cấu hình electron nguyên tử:
Li: [He]2s1; Na: [Ne]3s1;
K: [Ar]4s1; Rb: [Kr]5s1;
Cs: [Xe]6s1
⇒ Nguyên tử kim loại kiềm có 1e ở lớp ngoài cùng.
II. Tính chất vật lí
- Các kim loại kiềm có màu trắng bạc và có ánh kim, dẫn điện tốt, nhiệt độ nóng chảy, nhiệt độ sôi thấp, khối lượng riêng nhỏ và độ cứng thấp.

Kim loại Na
- Kim loại kiềm nhiệt độ nóng chảy, nhiệt độ sôi thấp, khối lượng riêng nhỏ và độ cứng thấp do:
+ Kim loại kiềm có cấu tạo tinh thể lập phương tâm khối, cấu trúc tương đối rỗng.
+ Trong tinh thể, các nguyên tử và ion liên kết với nhau bằng liên kết kim loại yếu.
III. Tính chất hóa học
- Các kim loại kiềm có tính rất khử mạnh: M → M+ + 1e. Tính khử tăng dần từ Li đến Cs.
- Trong hợp chất, các kim loại kiềm có số oxi hóa +1.
1. Tác dụng với phi kim
Kim loại kiềm khử dễ dàng các nguyên tử phi kim thành ion âm.
Ví dụ:
+ Na tác dụng với oxi khô tạo peoxit:
2Na + O2 → Na2O2 (natri peoxit)
+ Na tác dụng với oxi không khí khô ở nhiệt độ phòng tạo Na2O.
4Na + O2 → 2Na2O (natri oxit)
+ Na nóng chảy tác dụng với Cl2 tạo thành natri clorua:
2Na + Cl2 → 2NaCl
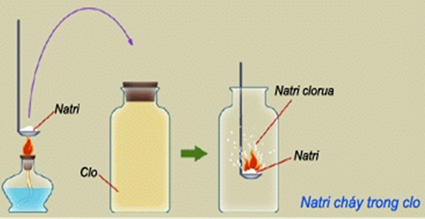
2. Tác dụng với axit
- Kim loại kiềm khử mạnh ion H+ trong dung dịch axit HCl và H2SO4 loãng thành khí H2:
2M + 2H+ → 2M+ + H2 ↑ (với M là kim loại kiềm)
- Phản ứng xảy ra mãnh liệt, tất cả các kim loại kiềm đều nổ khi tiếp xúc với axit.
3. Tác dụng với nước
- Kim loại kiềm khử nước dễ dàng ở nhiệt độ thường, giải phóng khí H2:
2M + 2H2O → 2MOH (dd) + H2 ↑ (với M là kim loại kiềm)
- Từ Li đến Cs phản ứng với nước xảy ra càng mãnh liệt. Do đó để bảo quản kim loại kiềm, người ta ngâm chìm các kim loại kiềm trong dầu hỏa.
IV. Ứng dụng, trạng thái tự nhiên và điều chế
1. Ứng dụng
Kim loại kiềm có nhiều ứng dụng quan trọng:
- Dùng chế tạo hợp kim có nhiệt độ nóng chảy thấp.
- Cs dùng chế tạo tế bào quang điện.
- Hợp kim liti – nhôm siêu nhẹ được dùng trong kĩ thuật hàng không.
2. Trạng thái tự nhiên
Trong tự nhiên kim loại kiềm không có ở dạng đơn chất mà chỉ tồn tại ở dạng hợp chất.
3. Điều chế
- Phương pháp: Điện phân nóng chảy muối halogenua hoặc hiđroxit của kim loại kiềm trong điều kiện không có không khí.
- Ví dụ:
2NaCl 2Na + Cl2
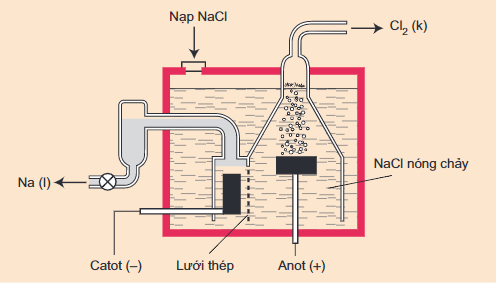
Sơ đồ thùng điện phân NaCl nóng chảy
B. Một số hợp chất quan trọng của kim loại kiềm
I. Natri hiđroxit, NaOH
1. Tính chất vật lí
+ NaOH là chất rắn, không màu, dễ nóng chảy, hút ẩm mạnh (dễ chảy rữa).

NaOH rắn
+ NaOH tan nhiều trong nước và tỏa ra một lượng nhiệt lớn nên cần tuyệt đối cẩn thận khi hòa tan NaOH trong nước.
2. Tính chất hóa học
- Khi tan trong nước, NaOH phân li hoàn toàn thành ion:
NaOH → Na+ + OH-
- NaOH là bazơ mạnh, mang đầy đủ tính chất của một bazơ tan:
+ Dung dịch NaOH làm quỳ tím chuyển sang màu xanh, phenolphtalein chuyển sang màu hồng.
+ Tác dụng với axit, oxit axit tạo thành muối và nước:
NaOH + HCl → NaCl + H2O
Chú ý: Khi tác dụng với axit và oxit axit trung bình, yếu thì tùy theo tỉ lệ mol các chất tham gia mà muối thu được có thể là muối axit, muối trung hòa hay cả hai loại muối.
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 → NaHCO3
+ Tác dụng với dung dịch muối tạo thành muối mới và bazơ mới:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
3. Ứng dụng
NaOH là hóa chất quan trọng, đứng hàng thứ hai sau H2SO4.
NaOH được dùng để nấu xà phòng, chế phẩm nhuộm, tơ nhân tạo, tinh chế quặng nhôm trong công nghiệp luyện nhôm và dùng trong công nghiệp chế biến dầu mỏ.
II. Natri hiđrocacbonat
1. Tính chất
- NaHCO3 là chất rắn, màu trắng, dễ tan trong nước.

NaHCO3
- NaHCO3 dễ bị nhiệt phân hủy tạo thành Na2CO3 và khí CO2:
2NaHCO3 Na2CO3 + CO2 + H2O
- NaHCO3 có tính lưỡng tính (vừa tác dụng với dung dịch axit, vừa tác dụng với dung dịch bazơ)
NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
2. Ứng dụng
NaHCO3 được dùng trong công nghiệp dược phẩm (chế tạo thuốc đau dạ dày …) và công nghiệp thực phẩm (làm bột nở …).
III. Natri cacbonat
1. Tính chất
- Natri cacbonat (hay soda) là chất rắn màu trắng, dễ tan trong nước.
- Na2CO3 là muối của axit yếu và có những tính chất hóa học chung của muối.
- Muối cacbonat của kim loại kiềm trong nước cho môi trường kiềm.
2. Ứng dụng
Na2CO3 là hóa chất quan trọng cho công nghiệp thủy tinh, bột giặt, phẩm nhuộm, giấy, sợi …
IV. Kali nitrat
1. Tính chất
- KNO3 là tinh thể, không màu, bền trong không khí, tan nhiều trong nước.

KNO3
- Khi đun nóng ở nhiệt độ trên 333oC, KNO3 bắt đầu bị phân hủy tạo thành KNO2 và O2
2KNO3 2KNO2 + O2
2. Ứng dụng
+ KNO3 được sử dụng làm phân bón (phân đạm, phân kali) và được dùng để chế tạo thuốc nổ. Thuốc nổ thông thường (thuốc súng) là hỗn hợp gồm 68% KNO3, 15% S và 17% C (than).
+ Phản ứng của thuốc súng xảy ra theo phương trình:
2KNO3 + 3C + S N2 ↑ + 3CO2 ↑+ K2S