Cho các phát hiểu sau:
1, Ion Ca2+ không bị oxi hóa hay bị khử khi Ca(OH)2 tác dụng với HCl
2, Nguyên tử Ca bị khử khi Ca tác dụng với O2
3, Caxi tác dụng với nước sau phản ứng tạo ra dung dịch kiềm.
4, Ion Ca2+ bị khử khi điện phân CaCl2 nóng chảy
5, Nguyên tử Ca bị oxi hóa khi Ca tác dụng với H2O.
Số phát biểu đúng là?
A. 2
B. 3
C. 4
D. 5
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án C
+) Ca(OH)2 + HCl → CaCl2 + 2H2O (số oxi hóa của Ca không đổi => Ca không bị oxi hóa và cũng không bị khử =>1, đúng
+) Ca thể hiện tính khử => Ca bị oxi hóa => 2, sai và 5, đúng
+) Khi điện phân nóng chảy Ca2+ chuyển thành Ca0 => Ca2+ đóng vai trò chất oxi hóa bị khử thành Ca0 => 4 đúng
+) Ca + H2O → Ca(OH)2 + H2 => 3 đúng
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Cho dãy các chất: KOH, Ca(NO3)2, SO2, SO3, NaHSO4, Na2SO3, K2SO4. Số chất trong dãy tạo thành kết tủa khi phản ứng với dung dịch BaCl2 là
Thạch cao nung được dùng để bó bột, đúc tượng do có hiện tượng giãn nở thể tích khi động cứng. Thành phần chính của thạch cao nung chứa.
Cho các ứng dụng sau:
a, Dùng để chế tạo hợp kim nhẹ cho công nghiệp sản xuất ô tô, máy bay
b, Dùng chế tạo dây dẫn điện
c, Dùng để chế tạo chất chiếu sáng
d, Dùng trong các quá trình tổng hợp hữu cơ. Số ứng dụng của Mg là
Hấp thụ hoàn toàn 3,36 lít (đktc) CO2 vào 500 ml dung dịch Ba(OH)2 nồng độ 0,2M thu được dung dịch X. Sau khi gạn bỏ kết tủa, khối lượng dung dịch X so với khối lượng dung dịch ban đầu
Chất nào sau đây tác dụng với lượng dư dung dịch Ba(OH)2 tạo thành kết tủa sau phản ứng ?
Cho các chất sau: CaCO3, BaSO4, Mg(OH)2, Ba(HCO3)2 . Số chất bị nhiệt phân?
Cho dd Ba(HCO3)2 lần lượt tác dụng với các dd sau: CaCl2, Ca(NO3)2, NaOH, NaHSO4, Ca(OH)2, H2SO4, HCl. Số phản ứng tạo ra kết tủa là
Đun nóng đến khối lượng không đổi hỗn hợp X gồm Mg(OH)2, Ca(NO3)2, BaCl2 thu được hỗn hợp chất rắn Y. Thành phần của hỗn hợp Y là
Cho các dung dịch sau: Ba(OH)2, NaHSO4, K2CO3, Ba(HCO3)2. Đổ lần lượt các dung dịch vào nhau. Số phản ứng xảy ra là
Sục từ từ V lít khí CO2 (đktc) từ từ vào 100 ml dung dịch hỗn hợp NaOH 2M; KOH 2M và Ba(OH)2 3 M. Kết thúc phản ứng thu được dung dịch chứa 62,7 gam muối. Biết các phản ứng xảy ra hoàn toàn. Giá trị lớn nhất của V thỏa mãn điều kiện của bài toán là
A. Kim loại kiềm thổ
I. Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử
- Kim loại kiềm thổ thuộc nhóm IIA của bảng tuần hoàn; gồm: Beri (Be); magie (Mg); canxi (Ca); stronti ( Sr); bari (Ba); rađi (Ra) (trong đó rađi là nguyên tố phóng xạ không bền).
- Cấu hình electron của nguyên tử các nguyên tố nhóm IIA:
Be: [He]2s2; Mg: [Ne] 3s2; Ca: [Ar] 4s2; Sr: [Kr] 5s2; Ba: [Xe]6s2
⇒ Các kim loại kiềm thổ đều có 2e ở lớp ngoài cùng.
II. Tính chất vật lý
- Các kim loại kiềm thổ có màu trắng bạc, có thể dát mỏng.

- Nhiệt độ nóng chảy và nhiệt độ sôi của các kim loại kiềm thổ tuy cao hơn các kim loại kiềm nhưng vẫn tương đối thấp.
- Độ cứng hơi cao hơn các kim loại kiềm nhưng vẫn tương đối mềm.
- Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của các kim loại kiềm thổ không biến đổi theo một quy luật nhất định như kim loại kiềm, đó là do các kim loại kiềm thổ có cấu tạo mạng tinh thể không giống nhau.
III. Tính chất hóa học
- Kim loại kiềm thổ có tính khử mạnh nhưng yếu hơn so với kim loại kiềm. Trong các hợp chất chúng có số oxi hóa +2.
- Tính khử tăng từ Be đến Ra: M → M2+ + 2e
1. Tác dụng với phi kim
Kim loại kiềm thổ khử các nguyên tử phi kim thành ion âm. Ví dụ:
2Ca + O2 2CaO
Mg + Cl2 MgCl2
Ca + 2C CaC2
2. Tác dụng với dung dịch axit
a) Với axit HCl, H2SO4 loãng
- Kim loại kiềm thổ khử mạnh ion H+ trong các dung dịch axit HCl, H2SO4 loãng thành khí H2
M + 2H+ M2+ + H2↑
Ví dụ: Mg +2HCl → MgCl2 + H2
b) Với axit HNO3, H2SO4 đặc
- Kim loại kiểm có thể khử thành các hợp chất có mức oxi hoá thấp hơn.
Ví dụ:
Mg + 4HNO3 đặc Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 5H2SO4 đặc 4MgSO4 + H2S + 4H2O
3. Tác dụng với nước H2O
Ở nhiệt độ thường, Be không khử được nước, Mg khử chậm. Các kim loại còn lại khử mạnh nước giải phóng H2. Ví dụ:
Ca + 2H2O → Ca(OH)2 + H2 ↑
B. Một số hợp chất quan trọng của canxi
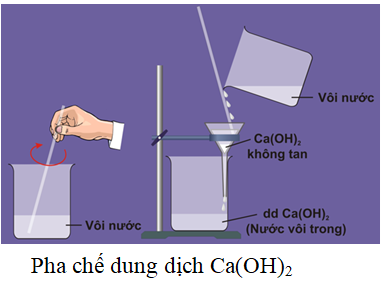
I. Canxi hiđroxit (Ca(OH)2)
- Canxi hiđroxit còn được gọi là vôi tôi, là chất rắn, màu trắng, ít tan trong nước. Nước vôi trong là dung dịch Ca(OH)2.
- Nước vôi trong mang đầy đủ tính chất hóa học của một bazơ tan.
- Ca(OH)2 hấp thụ dễ dàng CO2 theo phản ứng:
CO2 + Ca(OH)2 → CaCO3 (↓ trắng) + H2O
⇒ Phản ứng này thường được dùng để nhận biết khí CO2
- Ứng dụng: Ca(OH)2 là một bazơ mạnh, rẻ tiền nên được sử dụng rộng rãi trong nhiều ngành công nghiệp: sản xuất NH3; clorua vôi; vật liệu xây dựng …
II. Canxi cacbonat (CaCO3)
- CaCO3 là chất rắn màu trắng, không tan trong nước, bị phân hủy ở nhiệt độ cao khoảng 1000oC
CaCO3 CaO + CO2
- Ở nhiệt độ thường, CaCO3 tan dần trong nước có hòa tan CO2 tạo ra Ca(HCO3)2, chất này chỉ tồn tại trong dung dịch:
CaCO3 + H2O + CO2 Ca(HCO3)2
- Khi đun nóng hoặc áp suất CO2 giảm đi thì Ca(HCO3)2 bị phân hủy tạo ra CaCO3 kết tủa.
- Trong tự nhiên, canxi cacbonat tồn tại ở dạng đá vôi, đá hoa, đá phấn và là thành phần chính của các loại vỏ sò, hến, mực …
- Đá vôi dùng làm vật liệu xây dựng , sản xuất vôi, xi măng, thủy tinh … Đá hoa dùng trong các công trình mĩ thuật (tạc tượng, trang trí …); Đá phấn dễ nghiền thành bột mịn, làm phụ gia của thuốc đánh răng …

Thành phần chính của đá vôi là CaCO3
3. Canxi sunfat (CaSO4)
- Trong tự nhiên canxi sunfat tồn tại dưới dạng muối ngậm nước CaSO4.2H2O gọi là thạch cao sống.
- Khi đun nóng đến 160oC, thạch cao sống bị mất nước một phần tạo thành thạch cao nung (CaSO4. H2O).
CaSO4.2H2O CaSO4. H2O + H2O
- Nung thạch cao sống ở nhiệt độ 350oC được thạch cao khan (CaSO4).
CaSO4.2H2O CaSO4 + 2H2O
- Thạch cao nung có thể kết hợp với nước tạo thành thạch cao sống và khi đông cứng thì giãn nở thể tích, do vậy thạch cao rất ăn khuôn. Thạch cao nung thường được đúc tượng, đúc các mẫu chi tiết tinh vi dùng trang trí nội thất, làm phấn viết bảng, bó bột khi gãy xương…
C. Nước cứng
1. Khái niệm
- Nước chứa nhiều ion Ca2+, Mg2+ được gọi là nước cứng.
- Nước không chứa hoặc chứa ít các ion trên gọi là nước mềm.
2. Phân loại
Căn cứ vào thành phần các anion gốc axit có trong nước cứng, người ta chia nước cứng thành nước cứng có tính cứng tạm thời, vĩnh cửu và toàn phần.
+ Tính cứng tạm thời là tính cứng gây nên bởi các muối Ca(HCO3)2 và Mg(HCO3)2.
Gọi là tính cứng tạm thời vì chỉ cần đun sôi nước các muối này sẽ phân hủy tạo ra kết tủa MgCO3; CaCO3 nên sẽ mất tính cứng gây ra bởi các muối này.
+ Tính cứng vĩnh cửu là tính cứng gây nên bởi các muối sunfat, clorua của canxi và magie, gọi là vĩnh cữu vì khi đun nóng muối đó sẽ không phân hủy
+ Tính cứng toàn phần là gồm cả tính tạm thời và vĩnh cửu.
+ Nước tự nhiên thường có cả tính cứng tạm thời và vĩnh cửu.
3. Tác hại của nước cứng:
- Nước cứng gây nhiều tác hại trong đời sống và sản xuất:
+ Giặt áo quần bằng xà phòng trong nước cứng sẽ tạo ra muối không tan, chất này bán trên vải sợi, làm cho quần áo mau mục nát. Nước cứng làm cho xà phòng có ít bọt, giảm khả năng tẩy rửa.
+ Nếu dùng nước cứng để nấu thức ăn, sẽ làm cho thực phẩm lâu chín và giảm mùi vị do phản ứng của các ion và các chất trong thực phẩm.
+ Khi đun nóng, ở đáy nồi hay ống dẫn nước nóng sẽ gây ra lớp cặn đá kém dẫn nhiệt làm hao tổn chất đốt, gây nổ nồi hơi và tắt nghẽn ống dẫn nước nóng (không an toàn)..
Do đó việc làm mềm nước cứng trước khi dùng có ý nghĩa rất quan trọng.

Cặn CaCO3 làm tắc ống dẫn nước nóng
4. Phương pháp làm mềm nước cứng
- Nguyên tắc làm mềm nước cứng là giảm nồng độ các cation Ca2+, Mg2+ trong nước cứng.
- Phương pháp hóa học:
+ Đối với nước cứng tạm thời, đun nóng hoặc dùng Ca(OH)2 rồi lọc kết tủa:
Ca(HCO3)2 CaCO3 + CO2↑ + H2O
Mg(HCO3)2 + 2Ca(OH)2 → Mg(OH)2+ 2CaCO3↓ + 2H2O
+ Cả hai loại nước cứng đều có thể dùng dung dịch Na2CO3 (hoặc Na3PO4)
CaSO4 + Na2CO3 → CaCO3↓ + Na2SO4
Ca(HCO3)2 + Na2CO3 → CaCO3↓ + 2NaHCO3
- Phương pháp trao đổi ion: cho nước cứng qua chất trao đổi ion là các hạt zeolit thì số mol ion Na+ của zeolit rời khỏi mạng tinh thể, đi vào trong nước nhường chỗ cho các ion Ca2+ và Mg2+ bị giữ lại trong mạng tinh thể silicat.