Cho Al tác dụng với C ở nhiệt độ cao, lấy sản phẩm phản ứng trên cho tác dụng với H2O thì thu được kết tủa là :
A. Al(OH)3
B. CH4
C. Al4C3
D. CaCO3
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án A
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Trộn 0,54 gam bột Al với Fe2O3 và CuO, rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí, thu được hỗn hợp chất rắn X. Hòa tan X trong dung dịch HNO3 dư thu được 0,896 lít hỗn hợp khí Y gồm NO2 và NO ở đktc. Tỉ khối của hỗn hợp Y so với H2 là
Cho các phát biểu sau
a, Nhôm tan được trong dung dịch NaOH
b, Nhôm bị thụ động hóa với HNO3 đặc nguội và H2SO4 đặc nguội.
c, Nhôm là kim loại lưỡng tính.
d, Nhôm tác dụng với các axit ở tất cả mọi điều kiện.
Số phát biểu sai là?
Cho phản ứng: . Biết tỉ lệ NO và N2O là 1 : 3. Hệ số cân bằng của phản ứng trên là :
Nung hỗn hợp gồm 0,12 mol Al và 0,04 mol Fe3O4 một thời gian, thu được hỗn hợp rắn X. Hòa tan hoàn toàn X trong dung dịch HCl dư thu được 0,15 mol khí H2 và m gam muối. Giá trị của m là
Nhôm thể hiện tính chất nào sau đây?
1) Là kim loại màu trắng bạc, mềm, dễ kéo sợi và dát mỏng.
2) Nhôm dẫn điện và dẫn nhiệt tốt, tốt hơn các kim loại Fe và Cu.
3) Nhôm là kim loại nhẹ.
4) Nhôm là nguyên tố s.
Cho các phản ứng sau:
1, Al tác dụng với Fe3O4 nung nóng
2, Al tác dụng với axit H2SO4 đặc, nóng
3, Điện phân nóng chảy Al2O3
4, Al tác dụng với CuO nung nóng
5, Al tác dụng với Fe2O3 nung nóng
Số phản ứng thuộc loại phản ứng nhiệt nhôm là?
Có 3 chất rắn: Mg, Al, Al2O3 đựng trong 3 lọ mất nhãn. Chỉ dùng một thuốc thử nào sau đây có thể nhận biết được mỗi chất ?
Để giữ cho các đồ vật làm từ kim loại nhôm được bền, đẹp thì cần phải :
(1) Ngâm đồ vật trong nước xà phòng đặc, nóng, để làm sạch.
(2) Không nên cho đồ vật tiếp xúc với dung dịch nước chanh, giấm ăn.
(3) Dùng giấy nhám, chà trên bề mặt của vật, để vật được sạch và sáng.
(4) Bảo vệ bề mặt của vật như nhà thiết kế, sản xuất ban đầu.
Cách làm đúng là :
Trộn 0,25 mol bột Al với 0,15 mol bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí (giả sử chỉ có phản ứng khử Fe2O3 về Fe) thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, m gam chất rắn khan Z và 0,15 mol H2. Hiệu suất phản ứng nhiệt nhôm và giá trị của m lần lượt là
Cho các chất : Al, Al2O3, Al2(SO4)3, Zn(OH)2, NaHS, KHSO3, (NH4)2CO3. Số chất đều phản ứng được với dung dịch HCl, dung dịch NaOH là :
Cho hai thí nghiệm (TN) :
TN1 cho từ từ đến dư dung dịch HCl vào dung dịch NaAlO2.
TN2 cho từ từ đến dư khí CO2 vào dung dịch NaAlO2.
Hiện tượng quan sát được là :
Thực hiện phản ứng nhiệt nhôm 0,35 mol Al với 0,3 mol Fe2O3 thu được 0,2 mol Fe. Hiệu suất của phản ứng là
Có các lọ riêng biệt đựng các dung dịch không màu : CuCl2 , Al(NO3)3, Fe2(SO4)3, ZnCl2, KCl. Chỉ dùng dung dịch nào dưới đây để phân biệt các lọ mất nhãn trên ?
A. Nhôm (Al)
I. Vị trí trong bảng tuần hoàn và cấu hình electron nguyên tử
- Nhôm có số hiệu nguyên tử 13, thuộc nhóm IIIA, chu kì 3 của bảng tuần hoàn.
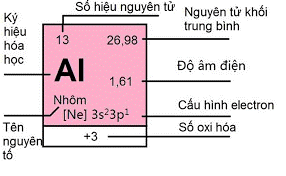
- Cấu hình electron: 1s22s22p63s23p1, hay [Ne]3s23p1 .
- Nhôm dễ nhường cả 3 electron hóa trị nên có số oxi hóa +3 trong các hợp chất.
II. Tính chất vật lý
- Nhôm là kim loại màu trắng bạc, nóng chảy ở 660oC, khá mềm, dễ kéo sợi, dễ dát mỏng.
- Nhôm là kim loại nhẹ (D = 2,7 g/cm3); dẫn điện, dẫn nhiệt tốt.

Nhôm
III. Tính chất hóa học
Nhôm là kim loại có tính khử mạnh (chỉ sau kim loại kiềm và kim loại kiềm thổ):
Al → Al3++ 3e
1. Tác dụng với phi kim
Nhôm khử dễ dàng các phi kim thành ion âm.
- Với oxi: Ở điều kiện thường, nhôm bền trong không khí do có lớp oxit rất mỏng, bền bảo vệ. Khi đốt, bột nhôm cháy trong không khí với ngọn lửa sáng chói, tỏa nhiều nhiệt:
4Al + 3O2 2Al2O3

Bột nhôm cháy trong không khí
- Bột nhôm tự bốc cháy khi tiếp xúc với clo
2Al + 3Cl2 → 2AlCl3
2. Tác dụng với axit
- Nhôm khử dễ dàng ion H+ trong dung dịch HCl và H2SO4 loãng thành H2.
2Al + 6HCl → 2AlCl3 + 3H2
- Al tác dụng mạnh với axit HNO3 loãng, H2SO4 đặc, nóng; HNO3 đặc, nóng.
Ví dụ:
Al + 4HNO3 loãng → Al(NO3)3 + NO + H2O
2Al + 6H2SO4 đặc Al2(SO4)3 + 3SO2 + 6H2O
- Nhôm không tác dụng với axit H2SO4 đặc, nguội; HNO3 đặc, nguội.
3. Tác dụng với oxit kim loại – Phản ứng nhiệt nhôm
- Ở nhiệt độ cao, Al khử được nhiều ion kim loại trong oxit như (Fe2O3, Cr2O3,CuO…) thành kim loại tự do.
- Ví dụ:
2Al + Fe2O3 Al2O3 + 2Fe.
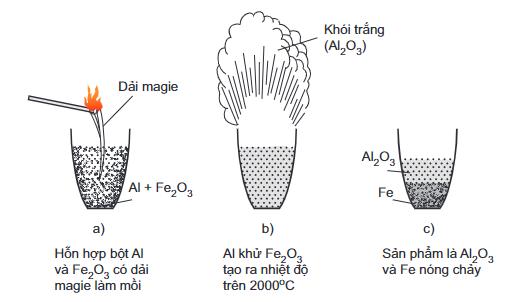
Phản ứng nhiệt nhôm
4. Tác dụng với nước
- Vật bằng nhôm không tác dụng với H2O ở bất kì nhiệt độ nào vì có lớp oxit bảo vệ. Nếu phá bỏ lớp bảo vệ, nhôm khử được nước ở nhiệt độ thường, nhưng phản ứng nhanh chóng dừng lại vì tạo kết tủa Al(OH)3.
5. Tác dụng với dung dịch kiềm
2Al + 2NaOH + 6H2O →2Na[(Al(OH)4] + 3 H2↑
Phương trình ion thu gọn:
2Al + 2OH- + 6H2O → 2[(Al(OH)4]- + 3 H2↑
Với chương trình cơ bản có thể viết:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3 H2 ↑
IV. Ứng dụng và trạng thái tự nhiên
1. Ứng dụng
- Nhôm và hợp kim của nhôm có ưu điểm nhẹ, bền đối với không khí và nước nên được dùng làm vật liệu chế tạo tên lửa, máy bay, ô tô, tàu vũ trụ …
- Nhôm và hợp kim của nhôm có màu trắng bạc, đẹp nên dùng để xây dựng nhà cửa, trang trí nội thất.
- Nhôm nhẹ, dẫn điện tốt nên được dùng làm dây dẫn điện.
- Nhôm dẫn điện tốt, ít bị gỉ, không độc nên được dùng làm dụng cụ nhà bếp.
- Bột nhôm trộn với oxit sắt (hỗn hợp tecmit) dùng để hàn đường ray.
2. Trạng thái tự nhiên
- Trong tự nhiên nhôm chỉ tồn tại dưới dạng hợp chất.
- Nhôm là nguyên tố phổ biến thứ 3 trong vỏ trái đất, sau oxi và silic.
- Hợp chất của nhôm có trong đất sét, mica, boxit, criolit …

Quặng boxit
V. Sản xuất nhôm
Trong công nghiệp nhôm được sản xuất bằng cách điện phân nhôm oxit nóng chảy.
1. Nguyên liệu
Quặng boxit, thành phần chính: Al2O3.2H2O
2. Điện phân nhôm oxit nóng chảy
+ Ở catot (cực âm): Al3+ + 3e → Al
+ Ở anot (cực dương): 2O2- → O2 + 4e
Phương trình điện phân: 2Al2O3 4Al + 3O2
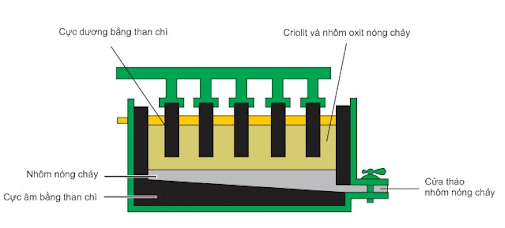
Sơ đồ thùng điện phân Al2O3 nóng chảy
Vai trò của criolit:
+ Giảm nhiệt độ nóng chảy của Al2O3.
+ Tăng khả năng dẫn điện của dung dịch điện phân.
+ Tạo lớp xỉ trên bề mặt, ngăn cản quá trình oxi hóa Al bởi oxi không khí.
B. Một số hợp chất quan trọng của nhôm
I. Nhôm oxit: Al2O3
1. Tính chất vật lý
Nhôm oxit là chất rắn màu trắng, không tan trong nước, không tác dụng với nước, nóng chảy ở nhiệt độ trên 2050oC.
2. Tính chất hóa học
Nhôm oxit là oxit lưỡng tính, vừa tác dụng với dung dịch axit, vừa tác dụng với dung dịch kiềm.
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
3. Ứng dụng
Trong tự nhiên, nhôm oxit tồn tại cả ở dạng ngậm nước và dạng khan.
- Dạng oxit ngậm nước là thành phần chủ yếu của quặng boxit dùng để sản xuất nhôm.
- Dạng oxit khan, có cấu tạo tinh thể là đá quý được dùng làm đồ trang sức, chế tạo đá mài …
- Bột nhôm oxit dùng trong công nghiệp sản xuất chất xúc tác cho tổng hợp hữu cơ.

Mẫu vật saphia
II. Nhôm hiđroxit: Al(OH)3
1. Tính chất vật lý
Nhôm oxit là chất rắn, màu trắng, kết tủa ở dạng keo.
2. Tính chất hóa học
+ Dễ bị nhiệt phân thành nhôm oxit:
2Al(OH)3 Al2O3 + 3H2O
+ Là hợp chất lưỡng tính, tan trong axit và bazơ:
Al(OH)3 + 3H+ → Al3+ + 3H2O
Al(OH)3 + OH- → AlO2- + 2H2O
III. Nhôm sunfat (Al2SO4)
- Muối nhôm sunfat khan tan trong nước tỏa nhiệt làm dung dịch nóng lên do bị hiđrat hóa.
- Muối nhôm sunfat có nhiều ứng dụng nhất là muối sunfat kép của nhôm và kali ngậm nước gọi là phèn chua, công thức K2SO4. Al2(SO4)3. 24H2O hay viết gọn KAl(SO4)2.12H2O.
- Phèn chua được sử dụng trong ngành thuộc da, công nghiệp giấy, chất cầm màu trong nhuộm vải, chất là trong nước…
IV. Cách nhận biết ion Al3+ trong dung dịch
Cho từ từ dung dịch NaOH đến dư vào dung dịch thí nghiệm, nếu thấy có kết tủa keo xuất hiện rồi tan trong NaOH dư chứng tỏ có Al3+:
Al3+ + 3OH- → Al(OH)3↓
Al(OH)3 ↓ + OH- dư → AlO2- + 2H2O