Để điều chế ta có thể dùng phản ứng nào sau đây ?
A.
B.
C.
D.
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án B
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Sắt tác dụng với ở nhiệt độ cao hơn thì tạo ra và sản phẩm rắn là
Nung hỗn hợp gồm 0,3 mol Fe và 0,2 mol S cho đến khi kết thúc phản ứng thu được chất rắn X. Cho X tác dụng với dung dịch HCl dư, thu được khí Y. Tỉ khối của Y so với không khí là
Dãy các phi kim nào sau đây khi lấy dư tác dụng với Fe thì chỉ oxi hoá Fe thành Fe(III)?
Cho 11,36 gam hồn hợp gồm Fe, FeO, phản ứng hết với dung dịch loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Dung dịch X có thể hoà tan tối đa 12,88 gam Fe. Số mol HNO3 có trong dung dịch ban đầu là
Dãy các chất và dung dịch nào sau đây khi lấy dư có thể oxi hoá Fe thành Fe(III)
Hoà tan 10 gam hỗn hợp bột Fe và bằng dung dịch loãng dư thu được 0,672 lít khí (đktc) và dung dịch X. Cho dung dịch X tác dụng vài NaOH dư, thu được kết tủa. Nung kết tủa trong không khí đến khối lượng không đổi được 11,2 gam chất rắn. Thể tích dung dịch 0,1M cần phản ứng vừa đủ với dung dịch X là
Cho m gam bột Fe vào 800 ml dung dịch hỗn hợp gồm 0,2M và 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,6m gam hỗn hợp bột kim loại và V lít khí NO (sản phẩm khử duy nhất của ở đktc). Giá trị của m và V lần lượt là:
Cho 2,24 gam Fe tác dụng với oxi, thu được 3,04 gam hỗn hợp X gồm 2 oxit. Để hoà tan hết X cần thể tích dung dịch HCl 2M là
Để m gam bột sắt trong không khí, sau một thời gian thu được 3 gam hỗn hợp oxit X. Hoà tan hết 3 gam X cần vừa đủ 500 ml dung dịch x (mol/l), thu được 0,56 lít khí NO (đktc) duy nhất và dung dịch không chứa . Giá trị của x là
Để a gam bột Fe trong không khí một thời gian, thu được 9,6 gam chất rắn X. Hoà tan hoàn toàn X trong dung dịch HNO3 loãng (dư), thu được dung dịch Y và khí NO (sản phẩm khử duy nhất của ). Cho dung dịch NaOH dư vào Y, thu được kết tủa, Lọc kết tủa rồi nung ở nhiệt độ cao đến khối lượng không đổi, thu được 12,0 gam chất rắn. Số mol HNO3 đã phản ứng là
Hoà tan hết cùng một lượng Fe trong dung dịch loãng (dư) và dung dịch đặc, nóng (dư) thì các thế tích khí sinh ra lần lượt là (đo ở cùng điều kiện). Liên hệ giữa là
Chia bột kim loại X thành 2 phần. Phần một cho tác dụng với tạo ra muối Y. Phần hai cho tác dụng với dung dịch HCl tạo ra muối Z. Cho kim loại X tác dụng với muối Y lại thu được muối Z. Kim loại X có thề là
I. Vị trí trong bảng tuần hoàn và cấu hình electron nguyên tử
- Sắt (Fe) thuộc ô 26, chu kì 4, nhóm VIIIB của bảng tuần hoàn.
- Cấu hình electron nguyên tử: 1s22s22p63s23p63d64s2 có thể viết gọn là [Ar]3d64s2.
- Nguyên tử sắt dễ dàng nhường 2e ở phân lớp 4s trở thành ion Fe2+ và có thể nhường thêm 1e ở phân lớp 3d trở thành Fe3+.
II. Tính chất vật lí
- Sắt là kim loại màu trắng, hơi xám, có khối lượng riêng lớn (D = 7,9 g/cm3), nóng chảy ở 1540oC.
- Sắt có tính dẫn nhiệt, dẫn điện tốt. Khác với các kim loại khác, sắt có tính nhiễm từ.

III. Tính chất hóa học
Sắt là kim loại có tính khử trung bình. Khi tác dụng với chất oxi hóa yếu, sắt bị oxi hóa đến số oxi hóa +2.
Fe → + 2e
Với chất oxi hóa mạnh, sắt bị oxi hóa đến số oxi hóa +3.
Fe → + 3e
1/ Tác dụng với phi kim:
Ở nhiệt độ cao, sắt khử nguyên tử phi kim thành ion âm và bị oxi hóa đến số oxi hóa +2 hoặc +3.
+ Tác dụng với lưu huỳnh:
+ Tác dụng với oxi:

Sắt cháy trong oxi
+ Tác dụng với clo:
2/ Tác dụng với axit
- Với dung dịch HCl, H2SO4 loãng, Fe bị oxi hóa đến số oxi hóa +2, giải phóng H2. Ví dụ:
Fe + H2SO4 → FeSO4 + H2
- Với dung dịch HNO3 và H2SO4 đặc nóng, Fe bị oxi hóa đến số oxi hóa +3, và không giải phóng H2. Ví dụ:
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O
Chú ý: Fe bị thụ động bởi các axit HNO3 đặc, nguội và H2SO4 đặc, nguội.
3/ Tác dụng với dung dịch muối
Fe có thể khử được ion của các kim loại đứng sau nó trong trong dãy điện hóa của kim loại. Trong các phản ứng này, Fe thường bị oxi hóa đến số oxi hóa +2. Ví dụ:
Fe + CuSO4 → FeSO4 + Cu
Đặc biệt:
Fe + 2Ag+ → Fe2+ + 2Ag
Nếu Ag+ dư, tiếp tục có phản ứng:
Fe2+ + Ag+ → Fe3+ + Ag
4/ Tác dụng với nước
Ở nhiệt độ thường, sắt không khử được nước, nhưng ở nhiệt độ cao, sắt khử hơi nước tạo ra H2 và Fe3O4 hoặc FeO.
3Fe + 4H2O Fe3O4 + 4H2
Fe + H2O FeO + H2
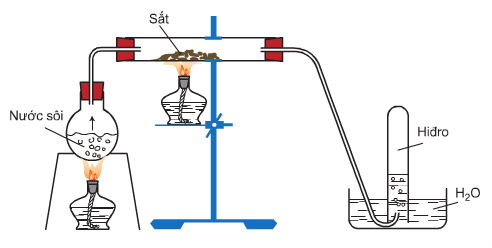
Sắt khử hơi nước ở nhiệt độ cao
IV: Trạng thái tự nhiên
- Sắt chiếm khoảng 5% khối lượng vỏ Trái Đất, đứng hàng thứ hai trong các kim loại (sau nhôm).
- Trong tự nhiên sắt tồn tại chủ yếu dưới dạng hợp chất.
- Các quặng sắt quan trọng là:
+ Quặng manhehit (Fe3O4) (hiếm có trong tự nhiên);
+ Quặng hemantit đỏ (Fe2O3)
+ Quặng hematit nâu (Fe2O3.nH2O)
+ Quặng xiderit (FeCO3)
+ Quặng pirit (FeS2).