Cho m gam hỗn hợp gồm Al và Cu vào dung dịch HCl dư, sinh ra 3,36 lít khí(đktc). Nếu cho m gam hỗn hợp trên vào lượng dư HNO3 đặc, nguội sinh ra 6,72 lít khí NO2 (sản phẩm khử duy nhất, đktc). Giá trị m là:
A. 11,2
B. 12,3
C. 14,5
D. 15,6
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án:B
- Khi tác dụng với HCl chỉ Al phản ứng sinh ra 0,15 mol H2
- Bảo toàn e: 3nAl=2.nH2
ð nAl=0,1mol
- Khi tác dụng với HNO3 đặc nguội, Al bị thụ động, chỉ Cu tác dụng
Bảo toàn e : 2nCu=nNO2
ð nCu= 0,3:2=0,15 mol
m = mCu+mAl=12,3 gam
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Để khử Fe3+ trong dung dịch thành ion Fe2+ có thể sử dụng lượng dư:
Trong không khí ẩm, các vật dụng bằng đồng bị bao phủ lớp gỉ màu xanh. Lớp gỉ đồng là:
Một dung dịch chứa 0,02 mol Cu2+, 0,03 mol K+, x mol Cl- và y mol SO42-. Tổng khối lượng các muối tan có trong dung dịch là 5,435 gam. Giá trị của x và y lần lượt là:
Cho hỗn hợp Cu, Fe phản ứng với dung dịch HNO3 loãng , sau phản ứng hoàn toàn thu được dung dịch chỉ chứa một chất tan và kim loại dư. Chất tan đó là:
Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là:
Cho sơ đồ phản ứng : Cu+ HNO3→ Cu(NO3)2 + NO +H2O
Sau khi lập phương trình hóa học của phản ứng , ta có số nguyên tử Cu bị oxi hóa và số phân tử HNO3 bị khử là:
Cho Cu tác dụng với các dung dịch sau: HNO3, HCl, AgNO3, Fe(NO3)2,Fe(NO3)3, Na2S. Số dung dịch Cu phản ứng được là:
I. Vị trí trong bảng tuần hoàn và cấu hình electron nguyên tử
- Đồng (Cu) ở ô số 29, thuộc nhóm IB, chu kì 4 của bảng tuần hoàn.
- Nguyên tử Cu có cấu hình electron bất thường: 1s22s22p63s23p63d104s1. Viết gọn là [Ar]3d104s1.
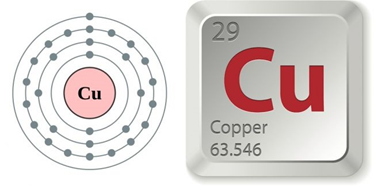
- Trong các hợp chất Cu có số oxi hóa +1 hoặc +2.
II. Tính chất vật lí
- Đồng là kim loại màu đỏ, có khối lượng riêng lớn (D = 8,98 g/cm3), nóng chảy ở 1083oC.
- Đồng tinh khiết tương đối mềm, dễ kéo dài và dát mỏng.
- Đồng dẫn điện và dẫn nhiệt tốt, chỉ kém bạc và hơn hẳn các kim loại khác.

Tấm kim loại đồng
III. Tính chất hóa học
Đồng là kim loại kém hoạt động, có tính khử yếu.
1. Tác dụng với phi kim
- Ở nhiệt độ thường, đồng có thể tác dụng với clo, brom nhưng tác dụng rất yếu với oxi. Ví dụ:
Cu + Cl2 → CuCl2
- Khi đun nóng, đồng tác dụng được với một số phi kim như oxi, lưu huỳnh. Ví dụ:
2Cu + O2 2CuO
- Chú ý: đồng không tác dụng được với hiđro, nitơ, cacbon.
2. Tác dụng với axit
- Đồng không khử được nước và ion H+ trong các dung dịch HCl và H2SO4 loãng.
- Với các dung dịch H2SO4 đặc, nóng và HNO3, đồng khử xuống và xuống hoặc :
Cu + 2H2SO4đặc CuSO4 + SO2 + 2H2O
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
IV. Hợp chất của đồng
- CuO là chất rắn, màu đen
- CuO là oxit bazơ, tác dụng dễ với axit và oxit axit. Ví dụ:
CuO + 2HCl → CuCl2 + H2O

Bột đồng(II) oxit
- Khi đun nóng, CuO dễ bị H2, CO, C khử thành đồng kim loại. Ví dụ:
CuO + H2 Cu + H2O
2. Đồng(II) hiđroxit Cu(OH)2
- Cu(OH)2 là chất rắn, màu xanh, không tan trong nước.

Kết tủa Cu(OH)2 hình thành sau phản ứng hóa học
- Cu(OH)2 là một bazơ, dễ tan trong các dung dịch axit. Ví dụ:
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
- Cu(OH)2 dễ bị nhiệt phân hủy:
Cu(OH)2 CuO + H2O
3. Muối đồng(II)
- Dung dịch muối đồng có màu xanh.

Dung dịch CuSO4 và CuSO4.5H2O
- Muối đồng thường gặp là muối đồng(II), như CuCl2, CuSO4, Cu(NO3)2 …
- Muối đồng(II) sunfat kết tinh ở dạng ngậm nước CuSO4.5H2O có màu xanh, dạng khan có màu trắng.
CuSO4.5H2O (màu xanh) CuSO4 (màu trắng) + 5H2O
4. Ứng dụng của đồng và hợp chất của đồng
- Trên 50% sản lượng đồng được dùng làm dây dẫn điện và trên 30% sản lượng đồng được dùng làm hợp kim.
- Hợp kim của đồng có nhiều ứng dụng trong công nghiệp và trong đời sống như chế tạo chi tiết máy, chế tạo các thiết bị dùng trong công nghiệp đóng tàu biển.
- Hợp chất của đồng cũng có nhiều ứng dụng:
+ Dung dịch CuSO4 dùng trong nông nghiệp để chữa bệnh mốc sương cho cà chua, khoai tây.
+ CuSO4 khan dùng để phát hiện dấu vết của nước trong các chất lỏng.
+ Đồng cacbonat bazơ CuCO3.Cu(OH)2 được dùng để pha chế sơn vô cơ màu xanh, màu lục.