Cho Na, Zn, Fe, Cu, dung dịch Fe(NO3)3, dung dịch Cu(NO3)2, dung dịch AgNO3 lần lượt tác dụng với nhau đôi một. Số trường hợp xảy ra phản ứng ở điều kiện thường là
A. 9
B. 10
C. 11
D. 12
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án C
Các trường hợp xảy ra phản ứng ở điều kiện thường:
- Na + dd Fe(NO3)3
- Na + dd Cu(NO3)2
- Na + dd AgNO3
-Zn + dd Fe(NO3)3
- Zn + dd Cu(NO3)2
- Zn + dd AgNO3
- Fe + dd Fe(NO3)3
- Fe + dd Cu(NO3)2
- Fe + dd AgNO3
- Cu + dd Fe(NO3)3
- Cu + dd AgNO3
Vậy có tất cả 11 trường hợp có thể xảy ra phản ứng
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Thực hiện các thí nghiệm sau
(a) Đun nóng hỗn hợp bột Fe dư và H2SO4 loãng
(b) Cho Fe vào dung dịch KCl
(c) Cho Fe(OH)2 vào dung dịch HNO3 loãng dư
(d) Đốt dây sắt trong Cl2
(e) Cho Fe3O4 vào dung dịch H2SO4 loãng dư
Số thí nghiệm có tạo ra muối sắt II là
Ba dung dịch X, Y, Z thỏa mãn:
- X tác dụng với Y thì có kết tủa xuất hiện:
- Y tác dụng với Z thì có kết tủa xuất hiện:
- X tác dụng với Z thì có khí bay ra
X, Y, Z lần lượt là
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau:
X, Y, Z, T lần lượt là:
Thực hiện các thí nghiệm sau:
(a) Nhiệt phân AgNO3
(b) Nung FeS2 trong không khí
(c) Nhiệt phân KNO3
(d) Nhiệt phân Cu(NO3)2
(e) Cho Fe vào dung dịch CuSO4
(g) Cho Zn vào dung dịch FeCl3 dư
(h) Điện phân dung dịch CuCl2
(i) Cho Ba vào dung dịch CuSO4 (dư)
Số thí nghiệm thu được kim loại sau khi các phản ứng kết thúc là
Một học sinh làm thí nghiệm với dung dịch X đựng trong lọ không dán nhãn và thu được kết quả như sau:
X đều phản ứng với cả 3 dung dịch : NaHSO4 , Na2CO3, AgNO3
X không phản ứng với cả 3 dung dịch NaOH, Ba(NO3)2, HNO3
Vậy dung dịch X là dung dịch nào sau đây ?
Tiến hành các thí nghiệm sau :
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư
(b) Sục khí H2S vào dung dịch FeCl3
(c) Cho FeS tác dụng với dung dịch HCl
(d) Cho dung dịch AgNO3 vào dung dịch HCl
(e) Cho tinh thể NaNO2 vào dung dịch NH4Cl bão hòa rồi đun nóng
Số thí nghiệm không sinh ra đơn chất là
Cho các thí nghiệm sau:
(a) Sục khí CO2 vào dung dịch natri aluminat
(b) Cho dung dịch NH3 dư vào dung dịch AlCl3
(c) Sục khí H2S vào dung dịch AgNO3 loãng dư
(d) Cho dung dịch NaOH dư vào dung dịch AlCl3
(e) Cho dung dịch NaOH dư vào dung dịch Ba(HCO3)2
(g) Cho stiren vào dung dịch KMnO4
(h) Cho dung dịch NaI vào dung dịch H2SO4 đậm đặc
Số thí nghiệm thu được kết tủa sau phản ứng là
Cho các thí nghiệm sau
(a) Cho Ba vào dung dịch chứa phèn chua
(b) Cho FeCl2 vào dung dịch AgNO3
(c) Cho Ca(OH)2 vào Mg(HCO3)2
(d) Sục khí NH3 vào dung dịch hỗn hợp CuCl2 và AlCl3
(e) Cho một miếng nhôm vào dung dịch NaOH dư rồi sục khí CO2 vào
Tổng số thí nghiệm có khả năng tạo kết tủa là :
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch Ca(OH)2 dư vào dung dịch Mg(HCO3)2.
(b) Cho dung dịch FeCl2 vào dung dịch AgNO3 (dư).
(c) Cho 2x mol Ba vào dung dịch chứa x mol Al2(SO4)3.
(d) Cho từ từ đến dư dung dịch NaOH vào dung dịch chứa AlCl3 và CuCl2.
(e) Cho dung dịch chứa 4a mol Ba(OH)2 vào dung dịch chứa 3a mol H3PO4 và đun nóng.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa gồm hai chất là
Để nhận biết 1 ion trong dung dịch, người ta thêm vào dung dịch 1 thuốc thử tạo với ion đó 1 sản phẩm đặc trưng như: chất kết tủa, hợp chất có màu, chất khí khó tan sủi bọt hoặc chất khí bay ra khỏi dung dịch…
II. Nhận biết một số cation trong dung dịch
1. Nhận biết cation Na+
- Để nhận biết ion Na+ ta dùng phương pháp vật lí thử màu ngọn lửa. Ion Na+ cháy cho ngọn lửa màu vàng tươi.

- Cách tiến hành: Cho một ít muối natri dưới dạng dung dịch hoặc muối rắn lên một dây platin hình khuyên gắn với một đũa thủy tinh nhỏ (dùng làm cán) rồi đưa đầu dây hình khuyên đó vào ngọn lửa đèn khí không màu thì thấy ngọn lửa nhuộm màu vàng tươi.
- Chú ý: Trong không khí của phòng thí nghiệm có nhiều bụi, trong bụi nhiều khi có lượng vết muối natri nên ta thấy ngọn lửa có màu vàng. Vì vậy, khi tiến hành thử ta nhúng dây platin nhiều lần vào dung dịch HCl sạch và chỉ kết luận sự có mặt của Na+ khi ngọn lửa có màu vàng tươi.
2. Nhận biết cation NH4+
- Thêm lượng dư dung dịch kiềm NaOH hoặc KOH …vào dung dịch chứa ion amoni rồi đun nóng nhẹ, thấy giải phóng NH3, có mùi khai.
- Nhận ra khí NH3 bằng mùi khai của nó hoặc sự đổi màu của giấy quỳ tím tẩm ướt bằng nước cất (màu quỳ tím đổi sang màu xanh).
- Phương trình phản ứng dạng ion thu gọn: + OH- NH3 + H2O
3. Nhận biết cation Ba2+
Để nhận biết ion Ba2+ ta sử dụng dung dịch H2SO4 loãng hoặc các dung dịch chứa gốc SO42-.
+ Hiện tượng: thuốc thử này tạo với ion Ba2+ kết tủa màu trắng không tan trong thuốc thử dư.

+ Phương trình ion thu gọn: Ba2+ + SO42- → BaSO4↓
4. Nhận biết cation Al3+
- Để nhận biết ion Al3+ ta sử dụng dung dịch kiềm như: NaOH, KOH …
- Hiện tượng: Đầu tiên tạo thành hiđroxit Al(OH)3 kết tủa keo trắng. Sau đó, kết tủa này tan trong thuốc thử (kiềm) dư.

- Phương trình ion tổng quát:
Al3+ + 3OH- → Al(OH)3↓
Al(OH)3 + OH- dư → AlO2- + 2H2O
5. Nhận biết các cation Fe2+ và Fe3+
a) Nhận biết cation Fe3+
- Để nhận biết ion Fe3+ ta sử dụng dung dịch kiềm (như NaOH; KOH …) hoặc dung dịch amoniac (NH3).
- Hiện tượng: Phản ứng tạo kết tủa Fe(OH)3 màu nâu đỏ, kết tủa không tan khi thuốc thử dư.
- Phương ion thu gọn:
+ Fe3+ phản ứng với dung dịch kiềm:
Fe3+ + 3OH- → Fe(OH)3 ↓ nâu đỏ
+ Fe3+ phản ứng với dung dịch NH3:
Fe3+ + 3NH3 + 3H2O → 3NH4+ + Fe(OH)3 ↓nâu đỏ
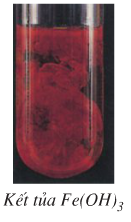
b) Nhận biết cation Fe2+
- Để nhận biết ion Fe2+ ta sử dụng dung dịch kiềm (OH-) ví dụ như NaOH, KOH,...
- Hiện tượng: Xuất hiện kết tủa Fe(OH)2 màu trắng hơi xanh:

Ngay sau đó, kết tủa này tiếp xúc với oxi không khí và bị oxi hóa thành Fe(OH)3. Vì vậy, kết tủa đang từ màu trắng hơi xanh, chuyển dần sang màu vàng rồi cuối cùng thành màu nâu đỏ.
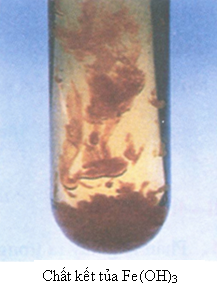
- Phương trình hóa học:
Fe2+ + 2OH- → Fe(OH)2↓ trắng xanh
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓ nâu đỏ
6. Nhận biết cation Cu2+
- Để nhận biết Cu2+ ta dùng dung dịch NH3.
- Hiện tượng: Ban đầu thuốc thử tạo với Cu2+ kết tủa Cu(OH)2 màu xanh, sau đó kết tủa bị hòa tan trong thuốc thử dư tạo thành dung dịch có màu xanh lam đậm.

- Phương trình phản ứng:
Cu2+ + 2NH3 + 2H2O → 2NH4+ + Cu(OH)2↓xanh lam
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (phức xanh đặc trưng)
III. Nhận biết một số anion trong dung dịch
1. Nhận biết anion NO3-
- Để nhận biết ion NO3- trong dung dịch ta có thể dùng bột Cu hoặc một vài mẩu lá Cu mỏng trong môi trường axit (axit sunfuric loãng)
- Hiện tượng: Bột Cu tan ra tạo thành dung dịch màu xanh, khí NO không màu bay lên gặp oxi của không khí, tạo thành khí NO2 có màu nâu đỏ.
+ Phương trình hóa học minh họa:
3Cu + 8H+ + 2 → 3Cu2+ + 2NO↑ + 4H2O
2NO (không màu) + O2 → 2NO2 (màu nâu đỏ)
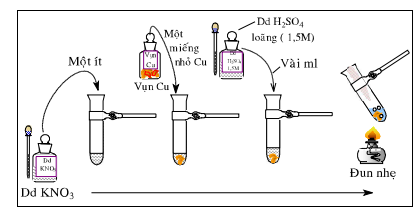
2. Nhận biết anion SO42-
- Để nhận biết ion SO42- ta sử dụng các dung dịch muối của bari (Ba2+), ví dụ như BaCl2, Ba(NO3)2… hoặc bari hiđroxit Ba(OH)2.
- Hiện tượng: Phản ứng sẽ cho kết tủa trắng không tan trong nước và axit mạnh.

+ Tổng quát: SO42- + Ba2+ → BaSO4 (↓ trắng)
3. Nhận biết anion Cl-
- Để nhận biết ion Cl- ta sử dụng dung dịch bạc nitrat (AgNO3).
+ Hiện tượng: Xuất hiện kết tủa trắng

+ Tổng quát: Ag+ + Cl- → AgCl (↓ trắng)
4. Nhận biết anion CO32-
a. Để nhận biết ion (CO32-) trong dung dịch ta sử dụng dung dịch axit mạnh như HCl, H2SO4 dư...
- Tổng quát: CO32-+ 2H+ dư → CO2↑ + H2O
- Hiện tượng: Có hiện tượng sủi bọt khí.

Ví dụ:
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
b. Nhận biết ion ( CO32-) bằng các hợp chất tan của Ba2+ hoặc Ca2+.
-Tổng quát: CO32- + Ba2+ → BaCO3 ↓trắng
CO32- + Ca2+ → CaCO3 ↓trắng
- Hiện tượng: Xuất hiện kết tủa trắng.
