Giải Sách bài tập Hoá học 10 Cánh diều Bài 9: Quy tắc octet
Với giải sách bài tập Hoá học 10 Bài 9: Quy tắc octet Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hoá học 10 Bài 9
Giải sách bài tập Hóa học lớp 10 Bài 9: Quy tắc octet
Bài 9.1 trang 26 SBT Hóa học 10: Nguyên tử oxygen (Z = 8) có xu hướng nhường hay nhận bao nhiêu electron để đạt lớp vỏ thoả mãn quy tắc octet? Chọn phương án đúng.
A. Nhường 6 electron.
B. Nhận 2 electron.
C. Nhường 8 electron.
D. Nhận 6 electron.
Lời giải:
Đáp án đúng là: B
Oxygen có cấu hình electron: 1s22s22p4.
Nguyên tử O có 6 electron ở lớp ngoài cùng, có xu hướng nhận thêm 2 electron để đạt lớp vỏ thỏa mãn quy tắc octet.
Bài 9.2 trang 26 SBT Hóa học 10: Nguyên tử lithium (Z = 3) có xu hướng nhường hay nhận bao nhiêu electron để lớp vỏ thoả mãn quy tắc octet? Chọn phương án đúng.
A. Nhường 1 electron.
B. Nhận 7 electron.
C. Nhuờng 11 electron.
D. Nhận 1 electron.
Lời giải:
Đáp án đúng là: A
Lithium (Z = 3) có cấu hình electron: 1s22s1.
Li có 1 electron ở lớp ngoài cùng, có xu hướng nhường đi 1 electron để đạt cấu hình của khí hiếm He.
Bài 9.3 trang 26 SBT Hóa học 10: Nguyên tử nào sau đây có thể nhường hoặc nhận bốn electron để đạt cấu hình electron bền vững?
A. Silicon.
B. Beryllium.
C. Nitrogen.
D. Selenium.
Lời giải:
Đáp án đúng là: A
Silicon nằm ở nhóm IV trong bảng tuần hoàn nên khi nhường hoặc nhận 4 electron sẽ tạo thành cấu hình electron bền vững của khí hiếm.
Silicon còn được gọi là á kim.
Bài 9.4 trang 26 SBT Hóa học 10: Nguyên tử nào sau đây không có xu hướng nhường hoặc nhận electron để đạt được lớp vỏ thoả mãn quy tắc octet?
A. Nitrogen.
B. Oxygen.
C. Sodium.
D. Hydrogen.
Lời giải:
Quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như khí hiếm.
- Nitrogen có 5 electron lớp ngoài cùng, có xu hướng nhận thêm 3 electron để đạt octet.
- Oxygen có 6 electron lớp ngoài cùng, có xu hướng nhận thêm 2 electron để đạt octet.
- Sodium có 1 electron ở lớp ngoài cùng, có xu hướng nhường đi 1 electron để đạt octet.
- Hydrogen có 1 electron trong nguyên tử, nếu hydrogen nhường đi 1 electron nó sẽ không còn electron nào; trong một số trường hợp đặc biệt, hydrogen nhận 1 electron để đạt cấu hình bền vững giống He.
Bài 9.5 trang 26 SBT Hóa học 10: Nguyên tử nào trong các nguyên tử sau đây không có xu hướng nhường electron để đạt lớp vỏ thoả mãn quy tắc octet?
A. Calcium.
B. Magnesium.
C. Potassium.
D. Chlorine.
Lời giải:
Đáp án đúng là: D
Chlorine có 7 electron ở lớp ngoài cùng, có xu hướng nhận thêm 1 electron để đạt cấu hình electron bền vững giống khí hiếm.
Bài 9.6 trang 26 SBT Hóa học 10: Hãy ghép mỗi nguyên tử ở cột A với nội dung được mô tả ở cột B cho phù hợp.
|
Cột A |
Cột B |
|
a) Ne (Z = 10) b) F (Z = 9) c) Mg (Z = 12) d) He (Z = 2) |
1. có xu hướng nhận thêm 1 electron. 2. có cấu hình lớp vỏ ngoài cùng 8 electron bền vững. 3. có xu hướng nhường đi 2 electron. 4. có cấu hình lớp vỏ ngoài cùng 2 electron bền vững. |
Lời giải:
- a ghép với 2, giải thích:
Ne (Z = 10): cấu hình electron nguyên tử: 1s22s22p6, vậy Ne có cấu hình lớp vỏ ngoài cùng 8 electron bền vững.
- b ghép với 1, giải thích:
F (Z = 9): cấu hình electron nguyên tử: 1s22s22p5, vậy F có 7 electron ở lớp ngoài cùng, có xu hướng nhận thêm 1 electron.
- c ghép với 3, giải thích:
Mg (Z = 12): cấu hình electron nguyên tử: 1s22s22p63s2, vậy Mg có 2 electron ở lớp ngoài cùng, có xu hướng nhường đi 2 electron.
- d ghép với 4, giải thích:
He (Z = 2): cấu hình electron nguyên tử: 1s2, vậy He có cấu hình lớp vỏ ngoài cùng 2 electron bền vững.
Bài 9.7 trang 27 SBT Hóa học 10: Mô hình mô tả quá trình tạo liên kết hóa học sau đây phù hợp với xu hướng tạo liên kết hóa học của nguyên tử nào?
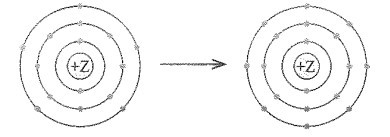
A. Aluminium.
B. Nitrogen.
C. Phosphorus.
D. Oxygen.
Lời giải:
Đáp án đúng là: C
Theo mô hình mô tả ta thấy nguyên tử này có 15 electron và nhận thêm 3 electron để đạt lớp vỏ thỏa mãn quy tắc octet.
Vậy nguyên tử này là phosphorus.
Bài 9.8 trang 27 SBT Hóa học 10: Nguyên tử có mô hình cấu tạo sau đây có xu hướng nhường hoặc nhận electron như thế nào khi hình thành liên kết hóa học?
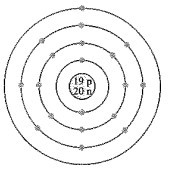
A. Nhận 1 electron.
B. Nhường 1 electron.
C. Nhận 7 electron.
D. Không có xu hướng nhường hoặc nhận electron.
Lời giải:
Đáp án đúng là: B
Quan sát mô hình nguyên tử thấy nguyên tử này có 19 electron, trong đó có 1 electron ở lớp ngoài cùng nên nguyên tử này dễ nhường 1 electron để đạt cấu hình electron vền vững của khí hiếm.
Bài 9.9 trang 27 SBT Hóa học 10: Nguyên tử có mô hình cấu tạo sau sẽ có xu hướng tạo thành ion mang điện tích nào khi nó thỏa mãn quy tắc octet?
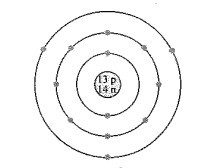
A. 3+.
B. 5+.
C. 3-.
D. 5-.
Lời giải:
Đáp án đúng là: A
Dựa vào mô hình nguyên tử, xác định được nguyên tử này có 13 electron, trong đó có 3 electron ở lớp ngoài cùng.
Vậy nguyên tử này có xu hướng nhường đi 3 electron để đạt octet. Điện tích của ion tạo thành là 3+.
Bài 9.10 trang 27 SBT Hóa học 10: Em hãy vẽ mô hình mô tả quá trình tạo lớp vỏ thỏa mãn quy tắc octet trong các trường hợp sau đây:
a) Nguyên tử O (Z = 8) nhận 2 electron để tạo thành anion O2-.
b) Nguyên tử Ca (Z = 20) nhường 2 electron để tạo ra cation Ca2+.
c) Hai nguyên tử fluorine “góp chung electron” để đạt được lớp vỏ thỏa mãn quy tắc octet.
Lời giải:
Các mô hình mô tả như sau:
a)
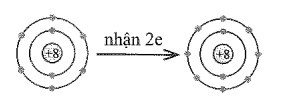
b)
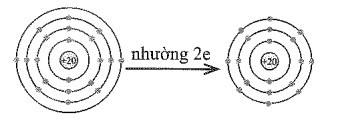
c)

Bài viết liên quan
- Giải Sách bài tập Hoá học 10 Cánh diều Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
- Giải Sách bài tập Hoá học 10 Cánh diều Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Giải Sách bài tập Hoá học 10 Cánh diều Bài 10: Liên kết ion
- Giải Sách bài tập Hoá học 10 Cánh diều Bài 11: Liên kết cộng hóa trị
- Giải Sách bài tập Hoá học 10 Cánh diều Bài 12: Liên kết hydrogen và tương tác van der Waals
