Dung dịch HF 0,02M có độ điện li α = 0,015. Nồng độ ion H+ có trong dung dịch là
 Giải bởi Vietjack
Giải bởi Vietjack
Độ điện li α = 0,015 → [HF]phân li = 0,015.0,02 = 3.10-4 M
HF ⇆ H+ + F-
Ban đầu: 0,02M 0
Phân li: 3.10-4 M → 3.10-4 M
Cân bằng: 0,0197 M 3.10-4 M
Đáp án cần chọn là: A
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Tính nồng độ mol của CH3COOH, CH3COO− và H+ trong dung dịch CH3COOH 0,056M, biết rằng độ điện li α của CH3COOH bằng 20%.
Tính thể tích dung dịch Ba(OH)2 0,5M có chứa số mol ion OH– bằng số mol ion H+ có trong 200 ml dung dịch H2SO4 1M?
A là dung dịch HCl nồng độ 0,01M. Nồng độ của các ion trong dung dịch khi pha loãng A 100 lần là
Cho các mệnh đề sau
1 Chất điện ly mạnh có độ điện ly (α) > 1.
2 Chất điện ly mạnh có độ điện ly (α) = 1.
3 Chất không điện ly có độ điện ly (α) = 0.
4 Chất điện ly yếu có độ điện ly (α) = 1.
5 Chất điện ly yếu có độ điện ly 0 < (α) < 1.
Chọn đáp án đúng
Hòa tan 6 gam NaOH vào 44 gam nước được dung dịch A có khối lượng riêng bằng 1,12 g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
Trộn 150 ml dung dịch MgCl2 0,5M với 50 ml dung dịch NaCl 1M thì nồng độ ion Cl- trong dung dịch mới là
Độ điện li của dung dịch axit HCOOH 0,005M (biết trong dung dịch có [H+] = 0,001M) là
Trong các yếu tố sau
(1) Nhiệt độ
(2) Áp suất
(3) Xúc tác
(4) Nồng độ chất tan
(5) Diện tích tiếp xúc
(6) Bản chất chất điện li
Yếu tố nào ảnh hưởng đến hằng số điện li ?
Cho các chất sau: SO2, C6H6 , C2H6, Ca(HCO3)2, H2SO4, NaClO, Mg(OH)2. Số chất hòa tan vào trong nước tạo thành chất điện li là:
Hòa tan các chất sau vào nước để được các dung dịch riêng rẽ: NaCl, CaO, SO3, C6H12O6, CH3COOH, C2H5OH, Al2(SO4)3. Trong các dung dịch tạo ra có bao nhiêu dung dịch có khả năng dẫn điện?
Có 4 dung dịch: Natri clorua, rượu etylic (C2H5OH), axit axetic (CH3COOH), kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
I. Hiện tượng điện li
1. Thí nghiệm
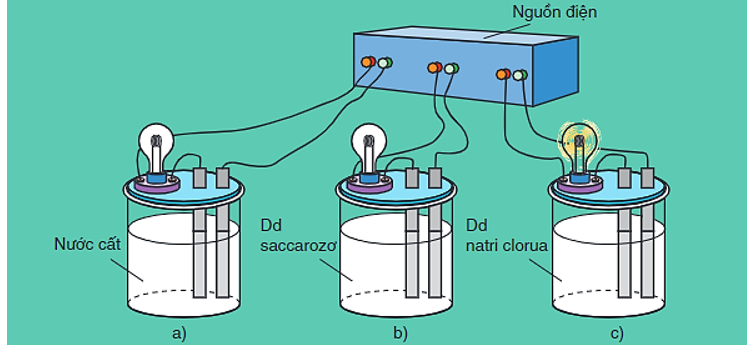
Hình 1: Bộ dụng cụ chứng minh tính dẫn điện của dung dịch
- Khi nối các đầu dây dẫn điện với cùng một nguồn điện, ta chỉ thấy bóng đèn ở cốc đựng dung dịch NaCl bật sáng.
⇒ Dung dịch NaCl dẫn điện, còn nước cất và dung dịch saccarozơ không dẫn điện.
- Nếu làm các thí nghiệm tương tự, người ta thấy:
+ NaCl rắn, khan; NaOH rắn, khan; các dung dịch ancol etylic (OH), glixerol ((OH)3) không dẫn điện.
+ Các dung dịch axit, bazơ và muối đều dẫn điện.
2. Nguyên nhân tính dẫn điện của các dung dịch axit, bazơ và muối trong nước
Nguyên nhân: Các dung dịch axit, bazơ và muối dẫn điện được là do trong dung dịch của chúng có các tiểu phân mang điện tích chuyển động tự do được gọi là các ion.
3. Các khái niệm cần nắm vững
- Sự điện li là quá trình phân li các chất trong nước ra ion.
- Chất điện li là những chất khi tan trong nước phân li ra ion.
⇒ Axit, bazơ và muối là những chất điện li.
- Sự điện li được biểu diễn bằng phương trình điện li.
Ví dụ:
- Muối phân li thành cation kim loại (hoặc cation amoni) và anion gốc axit:
NCl → N+ + Cl-
- Axit phân li thành cation H+ và anion gốc axit:
- Bazơ phân li thành cation kim loại và anion hiđroxit:
Chú ý: Nhiều chất khi nóng chảy cũng phân li ra ion, nên ở trạng thái nóng chảy các chất này dẫn điện được.
II. Phân loại các chất điện li
Dựa vào mức độ phân li ra ion, chất điện li được chia thành hai loại:
1. Chất điện li mạnh
- Chất điện li mạnh là chất khi tan trong nước, các phân tử hoà tan đều phân li ra ion.
- Những chất điện li mạnh là:
+ Các axit mạnh như HCl, HN, HCl, S, ...;
+ Các bazơ mạnh như NaOH, KOH, Ba(OH)2 ,...
+ Hầu hết các muối.
- Phương trình điện li, người ta dùng một mũi tên chỉ chiều của quá trình điện li.
Ví dụ:
Ba →
2. Chất điện li yếu
- Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử hoà tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
- Những chất điện li yếu là:
+ Các axit yếu như CCOOH, HClO, S, HF, S, ... ;
+ Các bazơ yếu như Bi, Mg, ...
+ Một số muối: HgC; Hg; …
+ Nước (O).
- Trong phương trình điện li của chất điện li yếu, người ta dùng hai mũi tên ngược chiều nhau.
- Sự phân li của chất điện li yếu là quá trình thuận nghịch, khi nào tốc độ phân li và tốc độ kết hợp các ion tạo thành phân tử bằng nhau cân bằng của quá trình điện li được thiết lập.
Ví dụ:
CCOOH
Lưu ý: Cân bằng điện li là cân bằng động và tuân theo nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê.