Thêm 90 ml nước vào 10 ml dung dịch NaOH có pH=12 thì thu được dung dịch có pH là:
A. 3
B. 1
C. 11
D. 13
 Giải bởi Vietjack
Giải bởi Vietjack
Vsau = 10−ΔpH . Vtruoc <=> (90+10) = 10−(pH−12).10
10=10−(pH−12) => pH = 11
Đáp án cần chọn là: C
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M thu được 2V ml dung dịch Y. Dung dịch Y có pH là
Thể tích dung dịch HCl 0,3M cần để trung hòa 100 ml dung dịch hỗn hợp NaOH 0,1M và Ba(OH)2 0,1M là
Trộn 200 ml dung dịch Ba(OH)2 0,01M với 200 ml dung dịch KOH 0,03M thu được dung dịch X. Giá trị pH của dung dịch X là
Trộn 20 ml dung dịch HCl 0,05M với 20 ml dung dịch H2SO4 0,075M. Nếu coi thể tích sau khi pha trộn bằng tổng thể tích của hai dung dịch đầu thì pH của dung dịch thu được là
Dung dịch X gồm NaOH 0,1M và Ba(OH)2 0,2M. Thể tích dung dịch H2SO4 0,5M cần để trung hòa hết 100 ml dung dịch X là
Tính pH của 300ml dung dịch (gồm 100 ml Ba(OH)2 0,1M và 200 ml NaOH 0,05M)
Để trung hòa 200ml dung dịch A chứa HCl 0,15M và H2SO4 0,05M cần dùng V lít dung dịch B chứa NaOH 0,2M và Ba(OH)2 0,1M, thu được m gam kết tủa. Giá trị của V và m là:
Trộn lẫn 50 ml dung dịch HCl 0,12M với 50 ml dung dịch NaOH 0,1M .Vậy pH của dung dịch thu được bằng bao nhiêu?
Cho 200 ml dung dịch X chứa hỗn hợp H2SO4 aM và HCl 0,1M tác dụng với 300 ml dung dịch Y chứa hỗn hợp Ba(OH)2 bM và KOH 0,05M, thu được 2,33 gam kết tủa và dung dịch Z có pH = 12. Giá trị của a và b lần lượt là
Cho 30 ml dung dịch H2SO4 0,002M vào 20 ml dung dịch Ba(OH)2 0,008M. Sau phản ứng thu được dung dịch X. pH của dung dịch X bằng
Cho dung dịch X chứa hỗn hợp H2SO4 0,1M và HNO3 0,3M, dung dịch Y chứa hỗn hợp Ba(OH)2 0,2M và KOH 0,1M. Lấy a lít dung dịch X cho vào b lít dung dịch Y, thu được 1 lít dung dịch Z có pH = 13. Giá trị a, b lần lượt là
I. Nước là chất điện li rất yếu
1. Sự điện li của nước
- Nước là chất điện li rất yếu. Thực nghiệm đã xác định được ở nhiệt độ thường cứ 555 triệu phân tử nước chỉ có 1 phân tử phân li ra ion.
- Phương trình điện li:
2. Tích số ion của nước
- Ở 25C, tích số = [H+].[OH-] được gọi là tích số ion của nước. Tích số này là hằng số ở nhiệt độ xác định. Tuy nhiên, giá trị tích số ion của nước thường được dùng trong các phép tính, khi nhiệt độ không khác nhiều so với 25C.
= [H+].[OH-] = 10^-14
⇒ [H+] = [OH-] = 10^-7 M.
- Môi trường trung tính là môi trường trong đó [H+] = [OH-] = 10^-7 M.
3. Ý nghĩa tích số ion của nước
a. Môi trường axit
- Là môi trường trong đó [H+] > [OH-] hay [H+] > 10^-7 M.
b. Môi trường kiềm
- Là môi trường trong đó [H+] < [OH-] hay [H+] < 10^-7 M.
Kết luận: Độ axit và độ kiềm của dung dịch có thể đánh giá bằng nồng độ H+.
+ Môi trường trung tính: [H+] = 10^-7 M.
+ Môi trường axit: [H+] > 10^-7 M.
+ Môi trường kiềm: [H+] < 10^-7 M.
II. Khái niệm về pH. Chất chỉ thị axit – bazơ
1. Khái niệm về pH
- pH được dùng để đánh giá độ axit và độ kiềm của dung dịch.
- Quy ước:
Tức là: thì pH = a.
Về mặt toán học:
- Thang pH thường dùng có giá trị từ 1 đến 14, trong đó:
+ pH < 7: môi trường axit.
+ pH > 7: môi trường bazơ.
+ pH = 7: môi trường trung tính.
- Giá trị của pH có ý nghĩa to lớn trong thực tế. Chẳng hạn, pH của máu người và động vật có giá trị gần như không đổi hay tốc độ ăn mòn kim mòn kim loại trong nước tự nhiên phụ thuộc rất nhiều vào giá trị pH của nước.
2. Chất chỉ thị axit – bazơ
- Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch.
Ví dụ: Quỳ tím, phenolphatalenin.
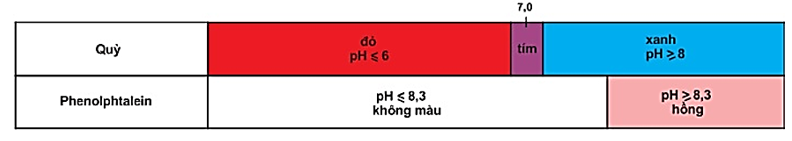
Hình 1: Màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau
- Trộn lẫn một số chất chỉ thị có màu biến đổi kế tiếp nhau theo giá trị pH, ta được hỗn hợp chất chỉ thị vạn năng.
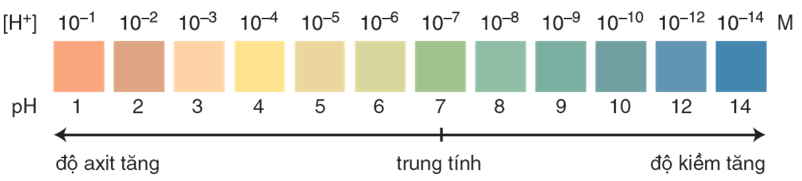
Hình 2: Màu của chất chỉ thị vạn năng (thuốc thử MERCK của Đức) ở các giá trị pH khác nhau
- Để xác định tương đối chính xác giá trị pH của dung dịch, người ta dùng máy đo pH.
3. Bảng công thức pH trong các môi trường
