Nhận xét nào sau đây không đúng về muối amoni ?
A. Muối amoni bền với nhiệt.
B. Các muối amoni đều là chất điện li mạnh.
C. Tất cả các muối amoni đều tan trong nước.
D. các muối amoni đều bị thủy phân trong nước.
 Giải bởi Vietjack
Giải bởi Vietjack
Chọn A
A không đúng vì các muối amoni đều kém bền với nhiệt.
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Trong thực tế, khi làm bánh thì người ta cho chất tạo độ xốp cho bánh. Chất này công thức là:
X là muối khi tác dụng với dung dịch NaOH dư sinh khí mùi khai, tác dụng với dung dịch sinh kết tủa trắng không tan trong . X là muối nào trong số các muối sau?
Trộn 300 ml dung dịch 2M với 200 ml dung dịch 2M rồi đun nóng cho đến khi phản ứng xảy ra hoàn toàn. Thể tích khí thu được ở đktc là
Cho 100 gam dung dịch 11,5% vào 100 gam dung dịch 13,68% và đun nhẹ. Thể tích khí (đktc) và khối lượng kết tủa thu được là (giả sử toàn bộ khí sinh ra thoát ra khỏi dung dịch)
Thực hiện phản ứng giữa (tỉ lệ mol 4 : 1) trong bình kín có xúc tác, thu được hỗn hợp khi có áp suất giảm 9% so với ban đầu (trong cùng điều kiện). Hiệu suất phản ứng là
Cho 22,4 lít hỗn hợp khí X gồm đi qua xúc tác Fe, nung nóng để tổng hợp thu được 20,16 lít hỗn hợp khí Y. Hấp thụ toàn bộ Y vào dung dịch dư, thu được m gam kết tủa. Các thể tích khí đó ở cùng điều kiện. Giá trị của m là
Oxi hóa 6 lít (tạo ra và NO theo tỉ lệ mol 1 : 4) cần vừa đủ V là không khí (chứa 20% oxi về thể tích). Các thể tích đó ở cùng điều kiện. Giá trị của V là
Điều chế từ hỗn hợp hồm (tỉ lệ 1 : 3) . Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,9. Hiệu suất phản ứng là
Trong các phản ứng sau, phản ứng nào đóng vai trò là chất oxi hóa ?
Hỗn hợp X gồm và . Cho X tác dụng với dung dịch dư, đun nhẹ thu được 9,32 gam kết tủa và 2,24 lít khí thoát ra. Hỗn hợp X có khối lượng là
A. AMONIAC
I. Cấu tạo phân tử
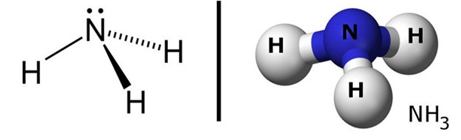
Hình 1: Sơ đồ cấu tạo và mô hình cấu tạo của phân tử N.
- Trong phân tử N, N liên kết với ba nguyên tử hiđro bằng ba liên kết cộng hóa trị có cực.
- Những đôi electron dùng chung bị lệch về phía nguyên tử N có độ âm điện lớn hơn.
- Phân tử N có cấu tạo hình chóp với nguyên tử nitơ ở đỉnh, đáy là một tam giác mà đỉnh là ba nguyên tử H.
- Nitơ còn một cặp electron hóa trị là nguyên nhân gây ra tính bazơ của N.
II. Tính chất vật lý
- Amoniac (N) là chất khí không màu, có mùi khai và xốc, nhẹ hơn không khí, tan rất nhiều trong nước.
- Ở điều kiện thường, 1 lít nước có hòa tan 800 lít amoniac.
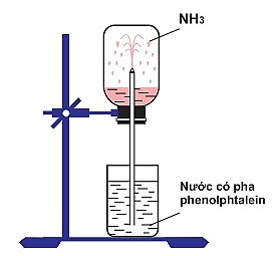
Hình 2: Sự hòa tan của amoniac trong nước
- Hòa tan N vào nước thu được dung dịch gọi là dung dịch amoniac. Dung dịch amoniac đậm đặc thường dùng trong phòng thí nghiệm có nồng độ 25% (D = 0,91g/cm3).
III. Tính chất hóa học
1. Tính bazơ yếu
a) Tác dụng với nước
N + O ⇄
⇒ Dung dịch N là một dung dịch bazơ yếu.
⇒ Có thể dùng quỳ tím ẩm để nhận biết khí amoniac, quỳ tím ẩm sẽ chuyển thành màu xanh.
b) Tác dụng với dung dịch muối
- Dung dịch amoniac có thể tác dụng với dung dịch muối của nhiều kim loại, tạo thành kết tủa hiđroxit của các kim loại đó.
AlC + 3N + 3O → Al(OH)3↓ + 3NCl
A+ + 3N + 3O → Al(OH)3↓ + 3
c) Tác dụng với axit → muối amoni:
N + HCl → NCl (amoni clorua)
2N + S → (N)2S (amoni sunfat)
2. Tính khử
- Amoniac có tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại.
a) Tác dụng với oxi
N cháy trong khí oxi cho ngọn lửa màu vàng, tạo ra khí nitơ và hơi nước.
4N + 3 2 + 6O
4N + 5 4NO + 6O
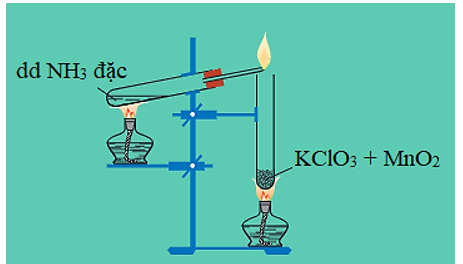
Hình 3: Khí amoniac cháy trong oxi
b) Tác dụng với clo
- Clo oxi hóa mạnh amoniac tạo ra nitơ và hiđro clorua:
2N + 3C → + 6HCl
- N kết hợp ngay với HCl vừa sinh ra tạo “khói trắng” NCl.
N + HCl → NCl
IV. Ứng dụng
- Sản xuất axit nitric, các loại phân đạm như urê (N)2CO; NN; (N)2S; …

Hình 4: Một số loại đạm
- Điều chế hiđrazin () làm nhiên liệu cho tên lửa.
- Amoni lỏng dùng làm chất gây lạnh trong thiết bị lạnh.
V. Điều chế
1. Trong phòng thí nghiệm
- Điều chế bằng cách đun nóng muối amoni (ví dụ NCl) với Ca(OH)2.
Phương trình hóa học:
2NCl + Ca(OH)2 CaC + 2N↑ + 2O
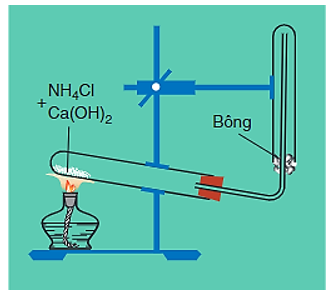
Hình 4: Điều chế khí amoniac trong phòng thí nghiệm
Lưu ý:
- Để làm khô khí, người ta cho khí amoniac vừa tạo thành có lẫn hơi nước đi qua bình đựng vôi sống (CaO).
- Khi muốn điều chế nhanh 1 lượng nhỏ khí N, người ta thường đun nóng dung dịch amoniac đậm đặc.
2. Trong công nghiệp
- Tổng hợp từ nitơ và hiđro, theo phản ứng:
+ 3 2N
- Điều kiện áp dụng:
+ Nhiệt độ: 450 – 500C.
+ Áp suất cao từ 200 – 300 atm.
+ Chất xúc tác: sắt kim loại được trộn thêm A, O, ...
- Làm lạnh hỗn hợp khí bay ra, N hóa lỏng được tách riêng.
B. MUỐI AMONI
- Là tinh thể ion gồm cation và anion gốc axit.
Thí dụ: NCl (amoni clorua), NN (amoni nitrat).
I. Tính chất vật lý
- Tất cả các muối amoni đều tan nhiều trong nước.
- Khi tan trong nước, điện li hoàn toàn thành các ion.
NCl → + Cl-
1. Tác dụng với dung dịch kiềm
- Dung dịch đậm đặc của muối amoni phản ứng với dung dịch kiềm khi đun nóng sinh ra khí amoniac.
Thí dụ:
NCl + NaOH N↑ + NaCl + O
Phương trình ion rút gọn là:
+ → N↑ + O
→ Phản ứng này để nhận biết ion amoni và điều chế amoniac trong phòng thí nghiệm.
2. Phản ứng nhiệt phân
Các muối amoni dễ bị phân hủy bởi nhiệt.
- Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
Thí dụ:
NCl (r) N↑ + HCl↑
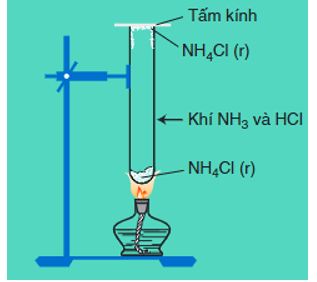
Hình 5: Sự phân hủy của NCl
- Các muối amoni cacbonat và amoni hiđrocacbonat bị phân hủy dần dần ngay ở nhiệt độ thường, khi đun nóng thì phản ứng xảy ra nhanh hơn.
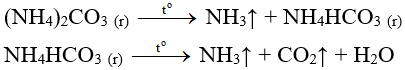
Lưu ý: NHC (bột nở) được dùng làm xốp bánh.
- Muối amoni chứa gốc của axit có tính oxi hóa như axit nitrơ, axit nitric khi bị nhiệt phân cho ra , O.
Thí dụ:
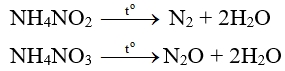
⇒ Những phản ứng này được sử dụng để điều chế các khí và O trong phòng thí nghiệm.