A.34,09%.
B.25,57%.
C.38,35%.
D.29,83%.
 Giải bởi Vietjack
Giải bởi Vietjack
Khi cho dung dịch Z tác dụng với BaCl2dư thì kết tủa thu được là BaSO4
\[ \to {n_{BaS{O_4}}} = \frac{{166,595}}{{233}} = 0,715\,\,mol\]
Bảo toàn gốc \[SO_4^{2 - } \to {n_{{H_2}S{O_4}}} = 0,715\,\,mol\]
Khi cho Z tác dụng với NaOH vừa đủ thu được khí là NH3
\[{n_{N{H_3}}} = \frac{{0,56}}{{22,4}} = 0,025\,\,mol \to {n_{NH_4^ + }} = 0,025\,\,mol\]
Bảo toàn điện tích cho dung dịch Z:
\[2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} + {n_{N{a^ + }}} = 2{n_{SO_4^{2 - }}}\]
Mà \[{n_{NaOH}} = 2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} = 1,285\,\,mol\]
\[ \to 1,285 + {n_{N{a^ + }}} = 2.0,715 \to {n_{N{a^ + }}} = 0,145mol\]
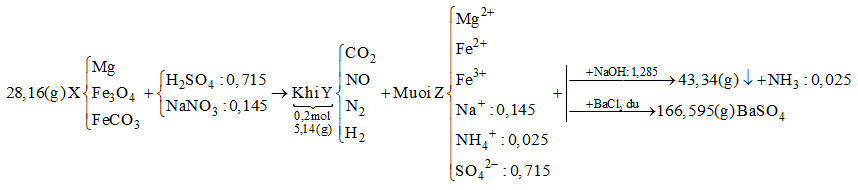
Ta có:
\[{n_{O{H^ - }{\kern 1pt} {\kern 1pt} (trong{\kern 1pt} {\kern 1pt} hidroxit)}} + {n_{NH_4^ + }} = {n_{NaOH}} \to {n_{O{H^ - }{\kern 1pt} {\kern 1pt} (trong{\kern 1pt} {\kern 1pt} hidroxit)}} = 1,285 - 0,025 = 1,26\,\,mol\]
Bảo toàn khối lượng:
\[{m_{Fe}} + {m_{Mg}} + {m_{O{H^ - }{\kern 1pt} {\kern 1pt} (trong{\kern 1pt} {\kern 1pt} hidroxit)}} = 43,34 \to {m_{Fe}} + {m_{Mg}} + 1,26.17 = 43,34\]
\[ \to {m_{Fe}} + {m_{Mg}} = 21,92g\]
Bảo toàn khối lượng cho dung dịch Z:
\[{m_{Mg}} + {m_{Fe}} + {m_{Na}} + {m_{NH_4^ + }} + {m_{SO_4^{2 - }}} = 21,92 + 0,145.23 + 0,025.18 + 0,715.96 = 94,345g\]
Bảo toàn khối lượng cho phản ứng:
\[{m_X} + {m_{{H_2}S{O_4}}} + {m_{NaN{O_3}}} = {m_Z} + {m_Y} + {m_{{H_2}O}}\]
\[ \to 28,16 + 0,715.98 + 0,145.85 = 94,345 + 5,14 + {m_{{H_2}O}}\]
\[ \to {m_{{H_2}O}} = 14,07g \to {n_{{H_2}O}} = 0,615\,\,mol\]
Bảo toàn nguyên tố H :\[2{n_{{H_2}S{O_4}}} = 2{n_{{H_2}}} + 4{n_{NH_4^ + }} + 2{n_{{H_2}O}}\]
\[ \to 2.0,715 = 2{n_{{H_2}}} + 4.0,025 + 2.0,615 \to {n_{{H_2}}} = 0,05\,\,mol\]
Đặt số mol của CO2, NO và N2lần lượt là x, y, z
\[ \to x + y + z + 0,05 = 0,2 \to x + y + z = 0,15\](*)
Tổng khối lượng Y là 5,14 \[ \to 44x + 30y + 28z + 0,05.2 = 5,14\]
\[ \to 44x + 30y + 28z = 5,04\](**)
Bảo toàn nguyên tố N :
\[{n_{NaN{O_3}}} = {n_{NO}} + 2{n_{{N_2}}} + {n_{NH_4^ + }} \to 0,145 = y + 2z + 0,025\]
\[ \to y + 2z = 0,12\](***)
Từ (*), (**) và (***) → x = 0,04; y = 0,01; z = 0,04
\[ \to {n_{FeC{O_3}}} = 0,04\,\,mol\]
Gọi số mol của Mg và Fe3O4lần lượt là a và b
\[ \to 24a + 232b + 116.0,04 = 28,16 \to 24a + 232b = 23,52\](1)
Vì tổng khối lượng của Mg và Fe trong hỗn hợp X là 21,92g
\[ \to 24a + 56.(3b + 0,04) = 21,92 \to 24a + 168b = 19,68\](2)
Từ (1) và (2) → a = 0,4; b = 0,06
\[ \to {\rm{\% }}{m_{Mg}} = \frac{{0.4.24}}{{28,16}}.100{\rm{\% }} = 34,09{\rm{\% }}\]
Đáp án cần chọn là: A
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Hòa tan hoàn toàn 8,9 gam hỗn hợp gồm Mg và Zn bằng lượng vừa đủ 500 ml dung dịch HNO31M. Sau khi các phản ứng kết thúc, thu được 1,008 lít khí N2O (đktc, khí duy nhất) và dung dịch X chứa m gam muối. Giá trị của m là
Hoà tan hết hỗn hợp X gồm Zn và ZnO trong dung dịch HNO3loãng dư thấy không có khí bay ra và trong dung dịch chứa 113,4 gam Zn(NO3)2và 8 gam NH4NO3. Phần trăm khối lượng Zn trong X là
Cho 6,4 gam Cu tan vừa đủ trong 200ml dung dịch HNO3thu được khí X gồm NO và NO2, dX/H2 = 18 (không còn sản phẩm khử nào khác của N+5). Nồng độ mol/lít của dung dịch HNO3đã dùng là
Thí nghiệm 1:Cho 6,4 gam Cu phản ứng với 120 ml dung dịch HNO31M được a lít NO.
Thí nghiệm 2:Cho 6,4 gam Cu phản ứng với 120 ml dung dịch HNO31M và H2SO40,5M được b lít NO.
Biết NO là sản phẩm khử duy nhất của N+5. Mối liên hệ giữa a và b là