Dung dịch đậm đặc của hợp chất nào sau đây được gọi là thủy tinh lỏng
A.
B.
C. NaOH và
D. KOH và
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án A
Thủy tinh lỏng là dung dịch đậm đặc của
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Trong phòng thí nghiệm, người ta thường bảo quản dung dịch HF trong các bình làm bằng:
Phản ứng dùng để khắc hình, khắc chữ lên thủy tinh là phản ứng giữa với:
Trong phản ứng hóa học nào sau đây silic đóng vai trò là chất oxi hóa
Oxit axit nào sau đây khi tác dụng với nước không tạo thành axit
Silic đioxit tan chậm trong dung dịch kiềm đặc, nóng, tan dễ trong dung dịch kiềm nóng chảy tạo thành silicat là
A. SILIC

- Silic ở ô thứ 14, nhóm IVA, chu kì 3 của bảng tuần hoàn.
- Cấu hình electron nguyên tử Si: [Ne]3s^23p^2
- Nguyên tử Si có thể tạo được tối đa 4 liên kết cộng hóa trị với các nguyên tử khác.
I. Tính chất vật lý
- Silic có hai dạng thù hình: silic tinh thể và silic vô định hình.
+ Silic tinh thể có cấu trúc giống kim cương, màu xám, có ánh kim, có tính bán dẫn, nóng chảy ở 1420C.
+ Silic vô định hình là chất bột màu nâu.
II. Tính chất hóa học
- Silic có các số oxi hóa: -4, 0, +2 và +4 (số oxi hóa +2 ít đặc trưng hơn).
- Trong các phản ứng hóa học, silic vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
- Silic vô định hình hoạt động hơn silic tinh thể.
1. Tính khử
a) Tác dụng với phi kim
- Silic tác dụng trực tiếp với flo ở nhiệt độ thường; với clo, brom, iot, oxi khi đun nóng; với cacbon, nitơ, lưu huỳnh ở nhiệt độ rất cao.
Thí dụ:
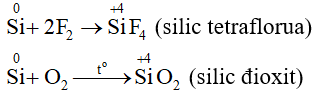
b) Tác dụng với hợp chất
- Silic tác dụng tương đối mạnh với dung dịch kiềm, giải phóng khí hiđro.
- Phương trình hóa học:
![]()
2. Tính oxi hóa
- Ở nhiệt độ cao, silic tác dụng với các kim loại như canxi, magie, sắt tạo thành silixua kim loại.
Thí dụ:
![]()
III. Trạng thái tự nhiên
- Silic là nguyên tố phổ biến thứ hai sau oxi, chiếm gần 29,5% khối lượng vỏ Trái Đất.
- Trong tự nhiên chỉ gặp silic dưới dạng các hợp chất, chủ yếu là cát (Si), các khoáng vật silicat và aluminosilicat như: cao lanh (A.2Si.2O), xecpentin (3MgO.2Si.2O), mica, đá xà vân, thạch anh, ...

Hình 1: Một số khoáng vật chứa silic
IV. Ứng dụng và điều chế
1. Ứng dụng
- Silic siêu tinh khiết là chất bán dẫn được dùng trong kĩ thuật vô tuyến và điện tử. Pin mặt trời chế tạo từ silic có khả năng chuyển năng lượng mặt trời thành điện năng, cung cấp cho các thiết bị trên tàu vũ trụ.

Hình 2: Pin mặt trời
- Trong luyện kim, hợp kim ferosilic được dùng để chế tạo thép chịu axit.
2. Điều chế
- Khử Si ở nhiệt độ cao bằng các chất khử mạnh như magie, nhôm, cacbon.
Thí dụ:
Si + 2Mg Si + 2MgO
B. HỢP CHẤT CỦA SILIC
I. Silic đioxit
- Si là chất ở dạng tinh thể, không tan trong nước.
- Tan chậm trong dung dịch kiềm đặc, nóng, tan dễ trong kiềm nóng chảy.
Si + 2NaOH NSi + O
- Tan được trong axit HF.
Si + 4HF → Si + 2O
⇒ Dựa vào tính chất này, người ta dùng dung dịch HF để khắc chữ lên thủy tinh.
II. Axit silixic
- Si là chất ở dạng keo, không tan trong nước. Khi mất một phần nước tạo thành vật liệu xốp là silicagen. Dùng để hút hơi ẩm trong các thùng đựng hàng hóa.
Hình 3: Silicagen
- Axit silixic là axit rất yếu, yếu hơn cả axit cacbonic nên bị đẩy ra khỏi dung dịch muối.
NSi + C + O → NC + Si↓
III. Muối silicat
- Đa số các muối silicat đều không tan, chỉ có muối silicat của kim loại kiềm tan được trong nước.
- Dung dịch đậm đặc của NSi và Si được gọi là thủy tinh lỏng. Thủy tinh lỏng dùng tẩm vải hoặc gỗ để chống cháy, dùng để chế tạo keo dán thủy tinh và sứ.

Hình 4: Thủy tinh lỏng