Hợp chất chỉ chứa liên kết σ trong phân tử thuộc loại hợp chất
A. không no
B. mạch vòng
C. thơm
D. no
 Giải bởi Vietjack
Giải bởi Vietjack
Hợp chất chỉ chứa liên kết σ trong phân tử thuộc loại hợp chất no.
Đáp án cần chọn là: D
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Hiện tượng các chất có cấu tạo và tính chất hoá học tương tự nhau, chúng chỉ hơn kém nhau một hay nhiều nhóm metylen (-CH2-) được gọi là hiện tượng
Để biết rõ số lượng nguyên tử, thứ tự kết hợp và cách kết hợp của các nguyên tử trong phân tử hợp chất hữu cơ người ta dùng công thức nào sau đây?
Để biết tỷ lệ tối giản về số nguyên tử của các nguyên tố trong phân tử người ta dùng công thức nào sau đây?
I. Công thức cấu tạo
1. Khái niệm
- Công thức cấu tạo biểu diễn thứ tự và cách thức liên kết (liên kết đơn, liên kết bội) của các nguyên tử trong phân tử.
2. Các loại công thức cấu tạo
a) Công thức cấu tạo khai triển
- Biểu diễn trên mặt phẳng giấy tất cả các liên kết.
- Thí dụ: Công thức cấu tạo khai triển của rượu etylic (OH).
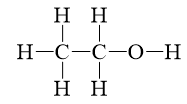
b) Công thức cấu tạo thu gọn
- Các nguyên tử, nhóm nguyên tử cùng liên kết với một nguyên tử cacbon được viết thành một nhóm.
Thí dụ: C – C – OH, C = CH – CH = C,…
- Hoặc chỉ biểu diễn liên kết giữa các nguyên tử cacbon và với nhóm chức.
+ Mỗi đầu một đoạn thẳng hoặc điểm gấp khúc ứng với một nguyên tử cacbon.
+ Không biểu thị số nguyên tử hiđro liên kết với mỗi nguyên tử cacbon.
- Thí dụ:
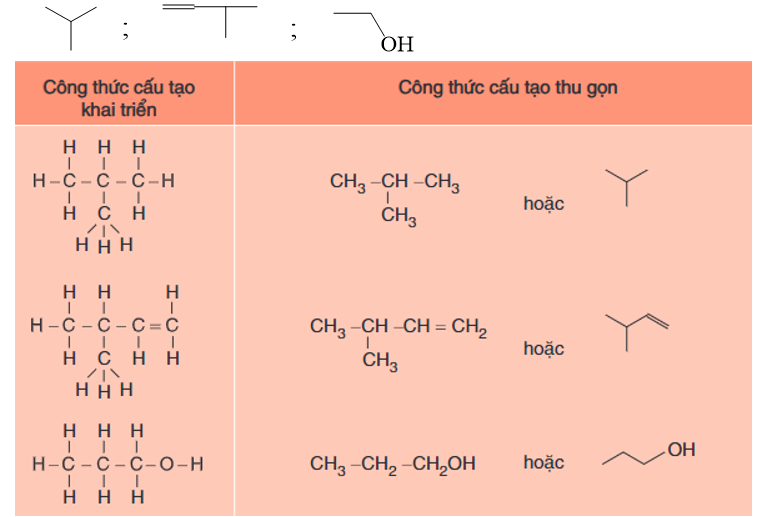
Hình 1: Một số thí dụ chuyển đổi công thức cấu tạo đầy đủ sang công thức thu gọn
II. Thuyết cấu tạo hóa học
1. Nội dung
- Trong phân tử hợp chất hữu cơ, các nguyên tử liên kết với nhau theo đúng hóa trị và theo một thứ tự nhất định. Thứ tự liên kết đó gọi là cấu tạo hóa học.
⇒ Sự thay đổi thứ tự liên kết đó, tức là thay đổi cấu tạo hóa học, sẽ tạo ra hợp chất khác.
Thí dụ: Công thức phân tử O có hai công thức cấu tạo ứng với 2 hợp chất sau:
C−O−C: đimetyl ete, chất khí, không tác dụng với Na.
C−C−OH: ancol etylic, chất lỏng, tác dụng với Na giải phóng hiđro.
- Trong phân tử hợp chất hữu cơ, cacbon có hóa trị 4. Nguyên tử cacbon không những có thể liên kết với nguyên tử các nguyên tố khác mà còn liên kết với nhau thành mạch cacbon.
Thí dụ:
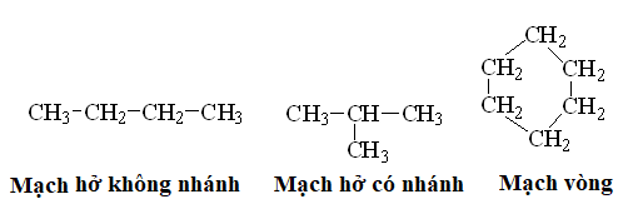
- Tính chất của các chất phụ thuộc vào thành phần phân tử (bản chất, số lượng các nguyên tử) và cấu tạo hóa học (thứ tự liên kết các nguyên tử).
Thí dụ:
+ Phụ thuộc thành phần phân tử: C là chất khí dễ cháy, CC là chất lỏng không cháy; CCl là chất khí không có tác dụng gây mê, còn CHC là chất lỏng có tác dụng gây mê.
+ Phụ thuộc cấu tạo hóa học: CCOH và COC khác nhau cả về tính chất hóa học.
2. Ý nghĩa
- Thuyết cấu tạo hóa học giúp giải thích được hiện tượng đồng đẳng, hiện tượng đồng phân.
II. Đồng đẳng đồng phân
1. Đồng đẳng
- Đồng đẳng là hiện tượng các chất hữu cơ có cấu tạo và tính chất hóa học tương tự nhau nhưng thành phần phân tử hơn kém nhau một hay nhiều nhóm C.
- Các chất thuộc cùng dãy đồng đẳng hợp thành một dãy đồng đẳng có công thức chung.
Thí dụ: Dãy đồng đẳng của metan: C, C – C, C – C – C,…
⇒ Công thức chung là CnH2n + 2.
2. Đồng phân
- Đồng phân là các chất hữu cơ có cùng công thức phân tử nhưng cấu tạo khác nhau nên tính chất hóa học khác nhau.
- Có hai loại đồng phân chính:
+ Đồng phân cấu tạo gồm: đồng phân mạch cacbon, đồng phân loại nhóm chức, đồng phân vị trí liên kết bội hoặc nhóm chức,…
+ Đồng phân lập thể: đồng phân khác nhau về vị trí không gian của các nhóm nguyên tử.
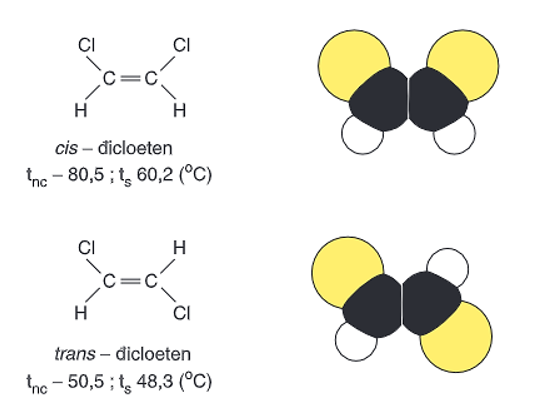
Hình 2: Đồng phân lập thể của CHCl = CHCl
II. Liên kết hóa học và cấu trúc phân tử hợp chất hữu cơ
- Liên kết thường gặp trong hợp chất hữu cơ là liên kết cộng hóa trị, gồm liên kết σ và liên kết π.
- Sự tổ hợp của liên kết σ và π tạo thành liên kết đôi hoặc ba (liên kết bội).
1. Liên kết đơn (σ)
- Do 1 cặp electron chung tạo thành, được biểu diễn bằng 1 gạch nối giữa 2 nguyên tử.
- Liên kết σ bền.
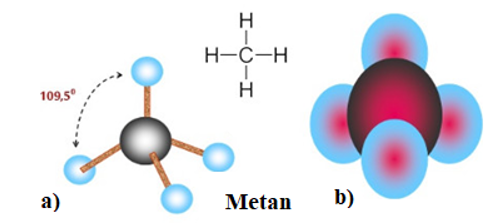
Hình 3: Mô hình phân tử metan dạng rỗng a) và dạng đặc b).
2. Liên kết đôi (1 σ và 1 π)
- Do 2 cặp electron chung tạo thành, được biểu diễn bằng 2 gạch nối song song giữa 2 nguyên tử.
- Gồm 1σ bền và 1 π kém bền.
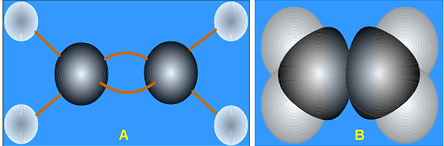
Hình 4: Mô hình phân tử etilen dạng rỗng A và dạng đặc B
c. Liên kết ba (1 σ và 2 π)
- Do 3 cặp electron chung tạo thành, được biểu diễn bằng 3 gạch nối song song giữa 2 nguyên tử.
- Gồm 1σ bền và 2 π kém bền.
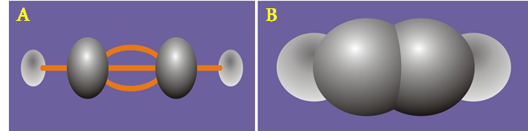
Hình 5: Mô hình phân tử axetilen dạng rỗng A và dạng đặc B