Chất nào sau đây có đồng phân hình học
A. CH2=CH−C≡CH
B. CH2=CHCl
C. CH3CH=CHCH=CH2
D. CH2=CHCH=CH2
 Giải bởi Vietjack
Giải bởi Vietjack
Chất có đồng phân hình học là CH3CH=CHCH=CH2
Đáp án cần chọn là: C
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Cho các chất: CH2=CH−CH=CH2; CH3−CH2−CH=C(CH3)2; CH3−CH=CH−CH=CH2; CH3−CH=CH2; CH3−CH=CH−COOH. Số chất có đồng phân hình học là
Số liên kết σ (xích ma) có trong mỗi phân tử: CH≡CH; CH2=CH2; CH2=CH-CH=CH2 lần lượt là:
Trong những dãy chất sau đây, dãy nào có các chất là đồng phân của nhau?
Trong những dãy chất sau đây, dãy nào có các chất là đồng phân của nhau?
Cho các chất sau: CH2=CH-CH2-CH2-CH=CH2; CH2=CH-CH=CH-CH2-CH3, CH3-C(CH3)=CH-CH3, CH2=CH-CH2-CH=CH2. Số chất có đồng phân hình học là
Cho các chất hữu cơ mạch thẳng sau: C3H6; C4H8; C3H8; C4H10; C5H10; C2H2; C2H5Cl. Số chất là đồng đẳng của C2H4 là
Cho các chất sau: CH3–O–CH3 (1), C2H5OH (2), CH3CH2CH2OH (3), CH3CH(OH)CH3 (4), CH3CH(OH)CH2CH3 (5), CH3OH (6). Những cặp chất là đồng phân của nhau
I. Công thức cấu tạo
1. Khái niệm
- Công thức cấu tạo biểu diễn thứ tự và cách thức liên kết (liên kết đơn, liên kết bội) của các nguyên tử trong phân tử.
2. Các loại công thức cấu tạo
a) Công thức cấu tạo khai triển
- Biểu diễn trên mặt phẳng giấy tất cả các liên kết.
- Thí dụ: Công thức cấu tạo khai triển của rượu etylic (OH).
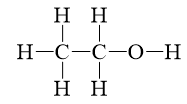
b) Công thức cấu tạo thu gọn
- Các nguyên tử, nhóm nguyên tử cùng liên kết với một nguyên tử cacbon được viết thành một nhóm.
Thí dụ: C – C – OH, C = CH – CH = C,…
- Hoặc chỉ biểu diễn liên kết giữa các nguyên tử cacbon và với nhóm chức.
+ Mỗi đầu một đoạn thẳng hoặc điểm gấp khúc ứng với một nguyên tử cacbon.
+ Không biểu thị số nguyên tử hiđro liên kết với mỗi nguyên tử cacbon.
- Thí dụ:
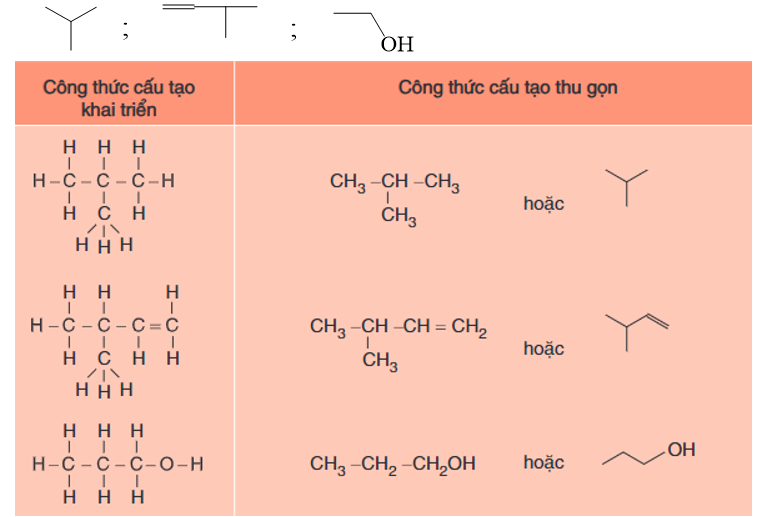
Hình 1: Một số thí dụ chuyển đổi công thức cấu tạo đầy đủ sang công thức thu gọn
II. Thuyết cấu tạo hóa học
1. Nội dung
- Trong phân tử hợp chất hữu cơ, các nguyên tử liên kết với nhau theo đúng hóa trị và theo một thứ tự nhất định. Thứ tự liên kết đó gọi là cấu tạo hóa học.
⇒ Sự thay đổi thứ tự liên kết đó, tức là thay đổi cấu tạo hóa học, sẽ tạo ra hợp chất khác.
Thí dụ: Công thức phân tử O có hai công thức cấu tạo ứng với 2 hợp chất sau:
C−O−C: đimetyl ete, chất khí, không tác dụng với Na.
C−C−OH: ancol etylic, chất lỏng, tác dụng với Na giải phóng hiđro.
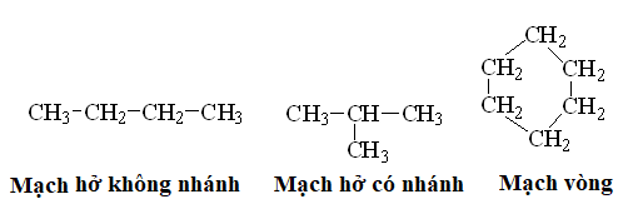
- Trong phân tử hợp chất hữu cơ, cacbon có hóa trị 4. Nguyên tử cacbon không những có thể liên kết với nguyên tử các nguyên tố khác mà còn liên kết với nhau thành mạch cacbon.
Thí dụ:
- Tính chất của các chất phụ thuộc vào thành phần phân tử (bản chất, số lượng các nguyên tử) và cấu tạo hóa học (thứ tự liên kết các nguyên tử).
Thí dụ:
+ Phụ thuộc thành phần phân tử: C là chất khí dễ cháy, CC là chất lỏng không cháy; CCl là chất khí không có tác dụng gây mê, còn CHC là chất lỏng có tác dụng gây mê.
+ Phụ thuộc cấu tạo hóa học: CCOH và COC khác nhau cả về tính chất hóa học.
2. Ý nghĩa
- Thuyết cấu tạo hóa học giúp giải thích được hiện tượng đồng đẳng, hiện tượng đồng phân.
II. Đồng đẳng đồng phân
1. Đồng đẳng
- Đồng đẳng là hiện tượng các chất hữu cơ có cấu tạo và tính chất hóa học tương tự nhau nhưng thành phần phân tử hơn kém nhau một hay nhiều nhóm C.
- Các chất thuộc cùng dãy đồng đẳng hợp thành một dãy đồng đẳng có công thức chung.
Thí dụ: Dãy đồng đẳng của metan: C, C – C, C – C – C,…
⇒ Công thức chung là CnH2n + 2.
2. Đồng phân
- Đồng phân là các chất hữu cơ có cùng công thức phân tử nhưng cấu tạo khác nhau nên tính chất hóa học khác nhau.
- Có hai loại đồng phân chính:
+ Đồng phân cấu tạo gồm: đồng phân mạch cacbon, đồng phân loại nhóm chức, đồng phân vị trí liên kết bội hoặc nhóm chức,…
+ Đồng phân lập thể: đồng phân khác nhau về vị trí không gian của các nhóm nguyên tử.
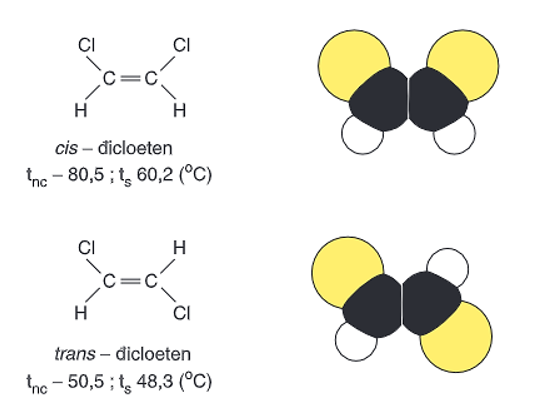
Hình 2: Đồng phân lập thể của CHCl = CHCl
II. Liên kết hóa học và cấu trúc phân tử hợp chất hữu cơ
- Liên kết thường gặp trong hợp chất hữu cơ là liên kết cộng hóa trị, gồm liên kết σ và liên kết π.
- Sự tổ hợp của liên kết σ và π tạo thành liên kết đôi hoặc ba (liên kết bội).
1. Liên kết đơn (σ)
- Do 1 cặp electron chung tạo thành, được biểu diễn bằng 1 gạch nối giữa 2 nguyên tử.
- Liên kết σ bền.
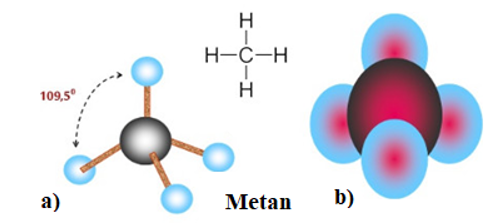
Hình 3: Mô hình phân tử metan dạng rỗng a) và dạng đặc b).
2. Liên kết đôi (1 σ và 1 π)
- Do 2 cặp electron chung tạo thành, được biểu diễn bằng 2 gạch nối song song giữa 2 nguyên tử.
- Gồm 1σ bền và 1 π kém bền.
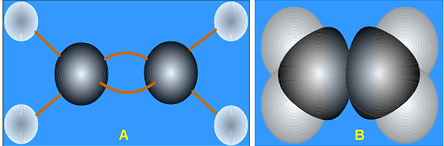
Hình 4: Mô hình phân tử etilen dạng rỗng A và dạng đặc B
c. Liên kết ba (1 σ và 2 π)
- Do 3 cặp electron chung tạo thành, được biểu diễn bằng 3 gạch nối song song giữa 2 nguyên tử.
- Gồm 1σ bền và 2 π kém bền.
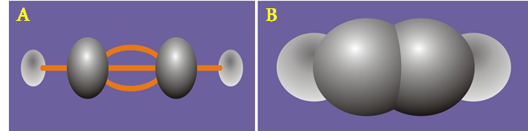
Hình 5: Mô hình phân tử axetilen dạng rỗng A và dạng đặc B