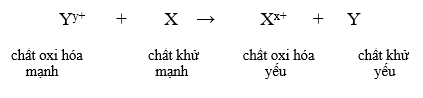
Dung dịch Fe2(SO4)3 tác dụng với lượng dư kim loại nào tạo dung dịch chứa hai muối?
A. Fe
B. Zn
C. Cu
D. Ag
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án C
Đáp án A:
Fe dư + Fe2(SO4)3 → FeSO4
Đáp án B:
Zn dư + Fe2(SO4)3 → ZnSO4 + Fe
Đáp án C:
Cu dư + Fe2(SO4)3 → FeSO4 + CuSO4
Đáp án D: Không phản ứng
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Kim loại nào sau đây khi tác dụng với HCl và tác dụng với Cl2 cho cùng một loại muối clorua:
Dãy cation kim loại được xếp theo chiều tăng dần tính oxi hóa từ trái sang phải là
Trong số các kim loại: nhôm, bạc, sắt, đồng, kim loại có tính dẫn điện kém nhất là:
Những tính chất vật lí chung của kim loại (tính dẻo, dẫn điện, dẫn nhiệt, ánh kim) gây ra do
Trong các kim loại: Al, Mg, Fe và Cu, kim loại có tính khử mạnh nhất là
Cho phản ứng hóa học :
Fe + CuSO4 → FeSO4 + Cu.
Trong phản ứng trên chất oxi hóa là
Cho các kim loại sau: Mg, Al, Cu, Cr, Ag. Số kim loại nào không tác dụng được với O2?
Ngâm một thanh sắt trong 100 ml dung dịch AgNO3 0,1 M. Giả sử kim loại sinh ra bám hết vào thanh sắt. Sau khi phản ứng hoàn toàn khối lượng thanh sắt tăng hay giảm bao nhiêu gam?
Hòa tan hoàn toàn 5,4 gam Al trong dung dịch H2SO4 dư. Khối lượng muối sinh ra là
Một tấm đồng kim loại bị bám một lớp Fe ở bề mặt. Ta có thể rửa lớp Fe để loại tạp chất bằng dung dịch
Các kim loại chỉ tác dụng với dung dịch H2SO4 loãng mà không tác dụng với dung dịch H2SO4 đặc nguội là
Kiến thức cần nắm vững
1. Cấu tạo của kim loại
a) Cấu tạo nguyên tử
Nguyên tử của hầu hết các nguyên tố kim loại có số electron lớp ngoài cùng ít (1, 2, 3e).
b) Cấu tạo tinh thể
Trong tinh thể kim loại, nguyên tử và ion kim loại nằm ở những nút mạng của tinh thể. Các electron hóa trị chuyển động tự do trong mạng tinh thể.
c) Liên kết kim loại
Liên kết kim loại là liên kết được hình thành giữa nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
2. Tính chất của kim loại
a) Tính chất vật lý chung
Các kim loại đều có tính dẻo, dẫn điện, dẫn nhiệt, có ánh kim do các electron tự do trong kim loại gây ra.
b) Tính chất hóa học:
- Các kim loại đều có tính khử: M → Mn+ + ne
- Nguyên nhân: Các electron hóa trị của nguyên tử kim loại liên kết yếu với hạt nhân nguyên tử, do đó các kim loại có khả năng nhường electron để tạo thành ion dương.
3. Dãy điện hoá của kim loại
- Người ta đã so sánh tính chất của nhiều cặp oxi hóa – khử và sắp xếp thành dãy điện hóa của kim loại:
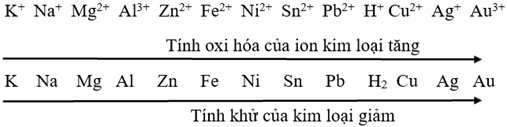
- Dãy điện hóa của kim loại cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hóa – khử theo quy tắc alpha (α): Phản ứng giữa hai cặp oxi hóa – khử sẽ xảy ra theo chiều chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn, sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn.
- Cách xác định chiều của phản ứng oxi hóa – khử theo quy tắc alpha:
Tổng quát
Giả sử có hai cặp oxi hóa khử: Xx+/ X và Yy+/Y (trong đó cặp Xx+/ X đứng trước cặp Yy+/Y trong dãy điện hóa). Xác định chiều của phản ứng oxi hóa khử.
Bước 1: Viết hai cặp oxi hóa – khử theo đúng thứ tự trong dãy điện hóa:
Bước 2: Áp dụng quy tắc alpha (α)
Phản ứng xảy ra theo chiều mũi tên như sau:
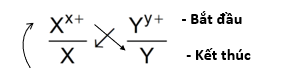
Bước 3: Xác định chiều phản ứng
Phản ứng xảy ra như sau: