Khối lượng bột nhôm cần dùng để thu được 78 gam crom từ bằng phản ứng nhiệt nhôm (giả sử hiệu suất phản ứng là 100%) là
A. 13,5 gam
B. 27,0 gam
C. 54,0 gam
D. 40,5 gam
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án D
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Muốn điều chế 6,72 lít khí clo ở đktc thì khối lượng tối thiều cần dùng đế tác dụng với dung dịch HCl đặc, dư là
Thêm 0,02 mol NaOH vào dung dịch chứa 0,01 mol rồi để trong không khí đến phản ứng hoàn toàn thì khối lượng kết tủa cuối cùng thu được là:
Cho 100,0 ml dung dịch NaOH 4,0 M vào 100,0 ml dung dịch thì thu được 10,3 gam kết tủa. Vậy nồng độ mol của dung dịch là:
Tiến hành phản ứng nhiệt nhôm với một hỗn hợp gồm 8,1 gam Al và 15,2 gam , sau phản ứng thu được hỗn hợp X. Cho hỗn hợp X vào dung dịch NaOH dư, đun nóng thấy thoát ra 5,04 lít (đktc). Khối lượng crom thu được là
Nung nóng 1,0 mol ở C thì tạo thành oxit crom có mầu lục và . Biết rằng hiệu suất phản ứng đạt 80%, thể tích khí (đktc) là
Nung hỗn hợp bột gồm 15,2 gam và m gam Al ở nhiệt độ cao. Sau khi phản ứng hoàn toàn, thu được 23,3 gam hồn hợp rắn X. Cho toàn bộ hỗn hợp X phản ứng với axit HCl nóng, dư thoát ra V lít (đktc) Giá trị của V là
Khối lượng cần dùng để oxi hoá hết 0,6 mol trong môi trường dung dịch loãng là
Sục khí vào dung dịch trong môi trường NaOH. Sản phẩm thu được là
I. Vị trí trong bảng tuần hoàn và cấu hình electron nguyên tử
- Crom ở ô số 24, thuộc nhóm VIB, chu kì 4 của bảng tuần hoàn.
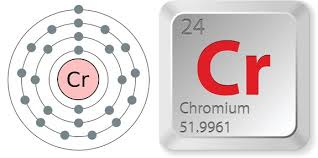
- Cấu hình electron nguyên tử: 1s22s22p63s23p6 3d54s1 viết gọn là [Ar]3d54s1.
- Nguyên tử crom có cấu hình electron bất thường như trên do một electron ở phân lớp 4s chuyển sang phân lớp 3d để có cấu hình electron bán bão hòa bền hơn.
II. Tính chất vật lý
- Crom là kim loại có màu trắng ánh bạc, rất cứng (là kim loại cứng nhất) có thể rạch được thủy tinh.
- Khối lượng riêng lớn (D = 7,2g/cm3), khó nóng chảy (nóng chảy ở 1890oC).

Kim loại crom
III. Tính chất hóa học
- Crom là kim loại có tính khử mạnh hơn sắt.
- Trong các phản ứng hóa học, crom tạo nên các hợp chất trong đó crom có số oxi hóa từ +1 đến +6 (thường gặp là +2; +3 và +6).
1. Tác dụng với phi kim
Ở nhiệt độ thường, crom chỉ tác dụng với flo. Ở nhiệt độ cao, crom tác dụng với oxi, clo,
lưu huỳnh…
4Cr + 3O2 2Cr2O3
2Cr + 3Cl2 2CrCl3
2Cr + 3S Cr2S3
2. Tác dụng với nước
Crom có độ hoạt động kém Zn và mạnh hơn Fe, nhưng crom bền hơn nước và không khí do có màng oxit rất mỏng, bền bảo vệ.
3. Tác dụng với axit
- Vì có màng bảo vệ, crom không tan ngay trong dung dịch loãng và nguội của axit HCl
H2SO4. Khi đun nóng, màng oxit này tan ra, crom tác dụng với axit giải phóng H2 và tạo
ra muối crom(II) khi không có không khí.
Cr + 2HCl → CrCl2 + H2
Cr + H2SO4 → CrSO4 + H2
Chú ý: Crom không tác dụng với dung dịch axit HNO3 đặc, nguội và H2SO4 đặc, nguội
do bị thụ động hóa.
IV – HỢP CHẤT CỦA CROM
1. Hợp chất crom(III)
a) Crom(III) oxit (Cr2O3)
- Là chất rắn, màu lục thẫm, không tan trong nước.

Crom(III) oxit
- Crom(III) oxit là oxit lưỡng tính, tan trong axit và kiềm đặc. Ví dụ:
Cr2O3 + 6HCl → 2CrCl3 + 3H2O
Cr2O3 + 2NaOH → 2NaCrO2 + H2O
- Cr2O3 được dùng tạo màu lục cho đồ sứ, đồ thủy tinh.
b) Crom(III) hiđroxit (Cr(OH)3)
- Là chất rắn, màu lục xám, không tan trong nước.

Cr(OH)3 kết tủa
- Crom(III) hiđroxit là một hiđroxit lưỡng tính, tan được trong dung dịch axit và dung dịch kiềm. Ví dụ:
Cr(OH)3 + NaOH → NaCrO2 + 2H2O
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
Chú ý: Vì ở trạng thái số oxi hóa trung gian, ion Cr3+ trong dung dịch vừa có tính oxi hóa (trong môi trường axit) vừa có tính khử (trong môi trường bazơ). Ví dụ:
2Cr3+ + Zn → 2Cr2+ + Zn2+
2CrO2- + 3Br2 + 8OH- → 2CrO42- + 6Br- + 4H2O
2. Hợp chất crom(VI)
a) Crom(VI) oxit (CrO3)
- Là chất rắn, màu đỏ thẫm.

Crom(VI) oxit
- CrO3 là một oxit axit, tác dụng với nước tạo ra axit:
CrO3 + H2O → H2CrO4
2CrO3 + H2O → H2Cr2O7
Những axit này không tách ra được ở dạng tự do mà chỉ tồn tại trong dung dịch.
- CrO3 có tính oxi hóa mạnh, một số chất vô cơ và hữu cơ như S, P, C, C2H5OH … bốc cháy khi tiếp xúc với CrO3.
b) Muối crom (VI)
- Muối cromat như natri cromat (Na2CrO4) và kali cromat (K2CrO4) là muối của axit
cromic, có màu vàng của ion cromat (CrO42-).
- Muối đicromat như natri đicromat Na2Cr2O7 và kali đicromat K2Cr2O7 là muối của axit
![]() icromat, có màu da cam của ion đicrom Cr2O72-
icromat, có màu da cam của ion đicrom Cr2O72-

Màu của muối crom(VI)
- Các muối cromat và đicromat có tính oxi hóa mạnh, đặc biệt trong môi trường axit muối
crom(VI) bị khử thành muối crom(III).
K2Cr2O7 + 6KI + 7H2SO4 → Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O.
K2Cr2O7 + 14HCl → 2KCl + 3CrCl3 + 3Cl2 + 7H2O