Khi đun nóng, phản ứng giữa cặp chất nào sau đây tạo ra ba oxit ?
A. Axit nitric đặc và cacbon
B. Axit nitric đặc và lưu huỳnh
C. Axit nitric đặc và đồng
D. Axit nitric đặc và bạc
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án: A.
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Trong những nhận xét dưới đây về muối nitrat của kim loại, nhận xét nào không đúng ?
A. Tất cả các muối nitrat đều dễ tan trong nước.
B. Các muối nitrat đều là chất điện li mạnh, khi tan trong nước phân li ra cation kim loại và anion nitrat.
C. Các muối nitrat đều dễ bị phân huỷ bởi nhiệt.
D. Các muối nitrat chỉ được sử dụng làm phân bón hoá học trong nông nghiệp.
Khi cho oxit của một kim loại hoá trị n tác dụng với dung dịch dư thì tạo thành 34,0 g muối nitrat và 3,6 g nước (không có sản phẩm khác). Hỏi đó là oxit của kim loại nào và khối lượng của oxit kim loại đã phản ứng là bao nhiêu ?
Nhiệt phân hoàn toàn 27,3 g một hỗn hợp rắn X gồm và , thu được hỗn hợp khí có thể tích 6,72 lít (đktc).
1. Viết phương trình hoá học của các phản ứng xảy ra.
2. Tính thành phần % về khối lượng của mỗi muối trong hỗn hợp X.
Cho tan bột kẽm tác dụng với dung dịch loãng, dư, thu được dung dịch A và hỗn hợp khí gồm và . Thêm NaOH dư vào dung dịch A, thấy có khí mùi khai thoát ra. Viết phương trình hoá học tất cả các phản ứng xảy ra dưới dạng phương trình ion rút gọn.
Có các chất sau đây : , , , , , . Hãy lập một dãy chuyển hoá biểu diễn mối quan hệ giữa các chất đó. Viết các phương trình hoá học và ghi điều kiện phản ứng, nếu có.
Dãy nào sau đây bao gồm các muối nitrat khi bị nhiệt phân đều tạo ra oxit kim loại?
Có năm lọ không dán nhãn đựng riêng từng dung dịch của các chất sau đây: , , , , KOH. Không được dùng thêm thuốc thử nào khác, hãy nêu cách nhận biết chất đựng trong mỗi lọ. Viết phương trình hoá học của các phản ứng đã được dùng để nhận biết.
Nhận xét nào sau đây là đúng?
A. Trong , nitơ có 5 liên kết cộng hóa trị.
B. Trong , nitơ có hóa trị V.
C. Trong , nitơ có số oxi hóa +5.
D. Axit nitric là axit mạnh và bền.
Dãy nào sau đây chứa tất cả các chất đều phản ứng được với axit nitric khi có đủ các điều kiện cần thiết?
Để nhận biết ion trong dung dịch, có thể dùng kim loại nhôm khử ion trong môi trường kiềm. Khi đó phản ứng tạo ra ion aluminat và giải phóng khí amoniac. Hãy viết phương trình hoá học ở dạng ion rút gọn.
Viết các phương trình hoá học thể hiện chuyển hoá muối natri nitrat thành muối kali nitrat, biết có đầy đủ hoá chất để sử dụng cho quá trình chuyển hoá đó.
Khi hoà tan 30,0 g hỗn hợp đồng và đồng(II) oxit. trong dung dịch 1,00 M lấy dư, thấy thoát ra 6,72 lít khí NO (đktc). Khối lượng của đồng (II) oxit trong hỗn hợp ban đầu là
A. 1,2 g. B. 4,25 g.
C. 1,88 g . D. 2,52 g.
A. AXIT NITRIC
I. Cấu tạo phân tử
- Công thức cấu tạo của HN:
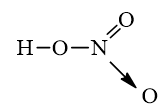
Chú ý: Mũi tên trong công thức cấu tạo trên cho biết cặp electron liên kết chỉ do nguyên tử N cung cấp.
- Trong hợp chất HN, nitơ có số oxi hóa cao nhất là +5.
II. Tính chất vật lý
- Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm.
- Axit nitric không bền, khi có ánh sáng phân hủy một phần sinh ra khí N. Khí này tan trong dung dịch axit, làm cho dung dịch có màu vàng.
4HN 4N↑ + ↑ + 2O
- Axit nitric tan vô hạn trong nước. Trong phòng thí nghiệm thường có loại HN đặc nồng độ 68%, D = 1,4 g/cm^3.
III. Tính chất hóa học
1. Tính axit
- Axit nitric là một trong số các axit mạnh nhất, trong dung dịch phân li hoàn toàn:
- Dung dịch axit HN có đầy đủ tính chất của một dung dịch axit: làm đỏ quỳ tím, tác dụng với oxit bazơ, bazơ, muối của axit yếu hơn.
Thí dụ:
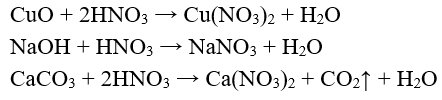
2. Tính oxi hóa
- HN có tính oxi hóa mạnh.
- Kim loại hay phi kim khi gặp axit HN đều bị oxi hóa lên trạng thái có mức oxi hóa cao nhất.
a) Tác dụng với kim loại
- HN oxi hóa hầu hết các kim loại trừ vàng (Au) và platin (Pt).
* Với những kim loại có tính khử yếu: Cu, Ag, ...
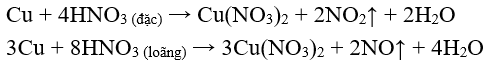
* Khi tác dụng với những kim loại có tính khử mạnh hơn: Mg, Zn, Al, ... thì HN loãng có thể bị khử đến O, hoặc NN.
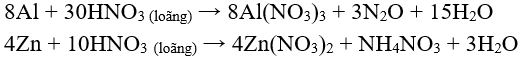
* Lưu ý: Fe, Al, Cr bị thụ động hóa trong dung dịch HN đặc, nguội.
b) Tác dụng với phi kim
- Khi đun nóng, HN đặc có thể tác dụng với phi kim: C, P, S, …(trừ và halogen).
Thí dụ:
S + 6HN (đ) → S + 6N↑ + 2O
c) Tác dụng với hợp chất
- S, HI, S, FeO, muối sắt (II), … có thể tác dụng với HN.
Thí dụ:
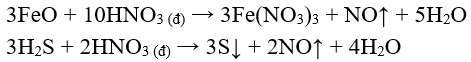
- Nhiều hợp chất hữu cơ như giấy, vải, dầu thông, … bốc cháy khi tiếp xúc với HN đặc.
IV. Ứng dụng
- Phần lớn sử dụng để điều chế phân đạm NN, …
- Ngoài ra, sử dụng sản xuất thuốc nổ, thuốc nhuộm, dược phẩm, …
V. Điều chế
1. Trong phòng thí nghiệm
Axit HN được điều chế bằng cách cho natri nitrat hoặc kali nitrat rắn tác dụng với axit S đặc, nóng:
NaN (rắn) + S (đặc) HN + NaHS
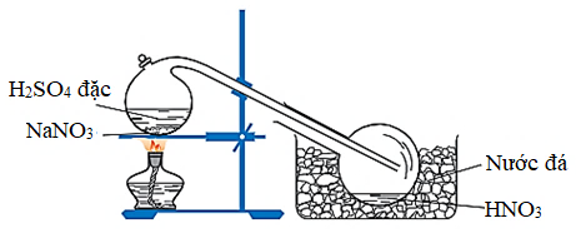
Hình 1: Điều chế axit nitric trong phòng thí nghiệm
2. Trong công nghiệp
- Được điều chế từ N qua ba giai đoạn:
N NO N HN.
a) Oxi hóa khí amoniac bằng oxi không khí
4N + 5 4NO + 6O;
b) Oxi hóa NO thành N bằng oxi không khí ở điều kiện thường
2NO + → 2N
c) Chuyển hóa N thành HN
4N + 2O + → 4HN
Dung dịch HN thu được thường có nồng độ 52 – 68%. Để có HN có nồng độ cao hơn 68% người ta thường chưng cất axit này với HN đậm đặc.
B. MUỐI NITRAT
- Muối của axit nitric được gọi là nitrat.
Thí dụ: natri nitrat NaN, bạc nitrat AgN,…
I. Tính chất vật lý
- Tất cả các muối nitrat đều dễ tan trong nước, là chất điện li mạnh trong dung dịch phân li hoàn toàn thành các ion.
Thí dụ:
Ca(N)2 → Ca2+ + 2
- Ion không màu, màu của 1 số muối nitrat là do màu của cation kim loại.
II. Tính chất hóa học
1. Nhiệt phân muối nitrat
a) Muối nitrat của các kim loại hoạt động mạnh (kali, natri,…)
Muối nitrat Muối nitrit + ↑
Thí dụ:
2NaN 2NaN + ↑
b) Muối nitrat của Mg, Zn, Fe, Pb, Cu,…
Muối nitrat Oxit kim loại + N↑ + ↑
Thí dụ:
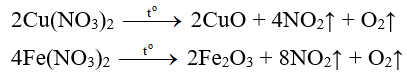
c) Muối nitrat của những kim loại Ag, Au, Hg,…
Muối nitrat Kim loại + N↑ + ↑
Thí dụ:
2AgN 2Ag + 2N↑ + ↑
2. Nhận biết ion nitrat
- Trong môi trường trung tính không có tính oxi hóa.
- Trong môi trường axit, ion thể hiện tính oxi hóa giống như HN.
⇒ Thuốc thử dùng để nhận biết ion là một ít vụn đồng và dung dịch S loãng, đun nóng.
Hiện tượng: dung dịch có màu xanh, khí không màu hóa nâu đỏ trong không khí.
3Cu + 8H+ + 2 → 3C+ + 2NO↑ + 4O
2NO + (không khí) → 2N (màu nâu đỏ)
III. Ứng dụng
- Các muối nitrat được sử dụng chủ yếu làm phân bón hóa học (phân đạm) trong nông nghiệp như NN, NaN, KN, Ca(N)2.

Hình 2: Một số loại phân đạm
- KN còn được sử dụng để chế thuốc nổ đen (thuốc nổ khói). Thuốc nổ đen chứa 75% KN, 10%S và 15% C.
C. Chu trình của nitơ trong tự nhiên
Nguyên tố nitơ rất cần cho sự sống trên Trái Đất. Trong tự nhiên, luôn luôn diễn ra các quá trình chuyển hóa nitơ từ dạng này sang dạng khác theo một chu trình tuần hoàn khép kín.
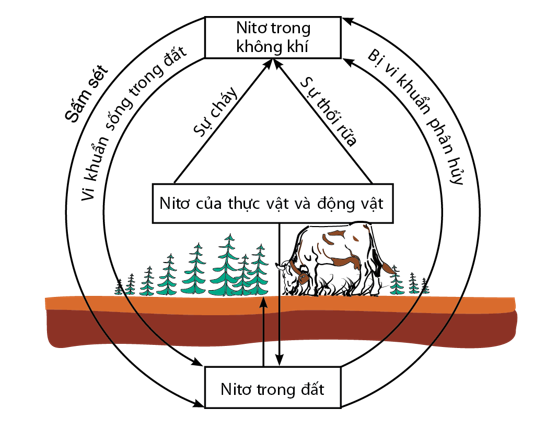
Hình 3: Chu trình của nitơ trong tự nhiên