Dung dịch loãng phản ứng được với :
A. Au
B. Fe
C. Ag
D. Cu
 Giải bởi Vietjack
Giải bởi Vietjack
Chọn B
Au, Ag, Cu là kim loại đứng sau H trong dãy hoạt động hóa học nên không phản ứng được với dd loãng.
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Cho 10,5 gam hỗn hợp hai kim loại Zn, Cu vào dung dịch loãng dư, người ta thu được 2,24 lít khí (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
Hoà tan hết 25,2 gam kim loại R trong dung dịch axit HCl, sau phản ứng thu được 10,08 lít (đktc). Kim loại R là
Để hoà tan vừa hết 4,48 gam Fe phải dùng bao nhiêu ml dung dịch hỗn hợp HCl 0,5M và 0,75M?
Hoà tan 12,1 g hỗn hợp bột kim loại Zn và Fe cần 400ml dung dịch HCl 1M. Khối lượng hỗn hợp muối thu được sau phản ứng là:
Hòa tan hoàn toàn hỗn hợp (Fe, Mg) bằng dung dịch HCl 20% (vừa đủ) thu được dung dịch A. Trong dung dịch A nồng độ của = 11,787%. Tính C% của trong dung dịch A
Hoà tan hoàn toàn 6,5 gam một kim loại A chưa rõ hoá trị vào dung dịch axit , thì thu được 2,24 lít (đktc). Kim loại A là
Cho 2,44 gam hỗn hợp muối và tác dụng vừa đủ với dung dịch 0,5M, sau phản ứng thu được 0,448 lít ở đktc. Thể tích dung dịch 0,5 M cần dùng là:
Cho hỗn hợp X gồm Al và Ag phản ứng với dung dịch axit thu được 5,6 lít (đktc). Sau phản ứng còn 3 gam một chất rắn không tan. Thành phần phần trăm theo khối lượng của Ag trong hỗn hợp X ban đầu là
Kim loại nào sau đây không tác dụng được với dung dịch axit HCl?
Cho 21 gam tác dụng với một lượng vừa đủ dung dịch HCl 2M. Thể tích dung dịch HCl đã dùng là:
I. Axit clohiđric (công thức hóa học: HCl)
- Khi hòa tan khí hiđro clorua (HCl, thể khí) vào nước ta thu được dung dịch axit clohiđric (HCl, thể lỏng).
- Dung dịch HCl đậm đặc là dung dịch bão hòa hiđro clorua, có nồng độ khoảng 37%, từ đây ta có thể pha chế thành dung dịch HCl có nồng độ khác nhau.
1. Tính chất hóa học:
Axit clohiđric có đầy đủ tính chất của một axit mạnh.
a) Làm đổi màu quỳ tím thành đỏ:
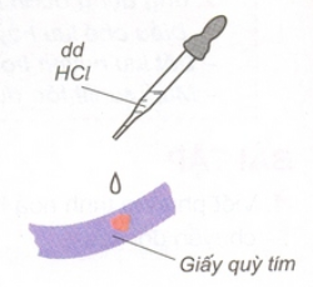
Hình 1: HCl làm đổi màu quỳ tím
b) Tác dụng với nhiều kim loại (Mg, Al, Zn, Fe,...) tạo thành muối clorua và giải phóng khí hiđro
Ví dụ:

Hình 2: Mg tác dụng với HCl
Chú ý:
- Các kim loại Hg, Cu, Ag, Au, Pt …không tác dụng với HCl.
- Các kim loại có nhiều hóa trị như Fe, Cr … khi tác dụng với HCl thu được muối trong đó kim loại ở mức hóa trị thấp. Ví dụ:
2HCl + Fe → Fe + H2 (↑)
c) Tác dụng với bazơ tạo thành muối clorua và nước.
Ví dụ:
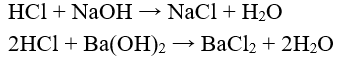
d) Tác dụng với oxit bazơ tạo thành muối clorua và nước.
Ví dụ:
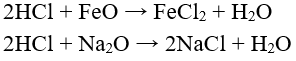
e) Tác dụng với một số muối tạo thành muối clorua và axit mới
Ví dụ:
2HCl + C → 2NaCl + C + O
2HCl + CaC → Ca + C↑ + O

Hình 3: CaC tác dụng với HCl
2. Ứng dụng.
Axit clohiđric dùng để:
- Điều chế các muối clorua.
- Làm sạch bề mặt kim loại trước khi hàn.
- Tẩy gỉ kim loại trước khi sơn, tráng, mạ kim loại.
- Dùng trong chế biến thực phẩm, dược phẩm…
II. Axit sunfuric (công thức hóa học S)
1. Tính chất vật lí
- Axit S là chất lỏng sánh, không màu, nặng gấp hai lần nước (ở nồng độ 98% có d = 1,83 g/cm3), không bay hơi, tan dễ dàng trong nước và tỏa rất nhiều nhiệt.
- Để pha loãng axit sunfuric đặc an toàn: Rót từ từ axit đặc vào bình đựng sẵn nước rồi khuấy đều bằng đũa thủy tinh. Tuyệt đối không được làm ngược lại.
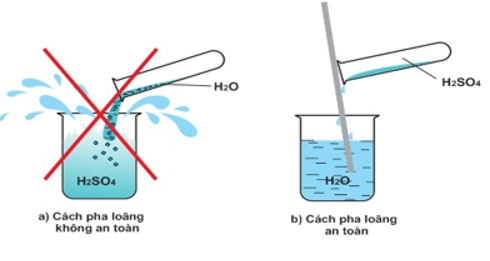
Hình 4: Cách pha loãng S đặc
2. Tính chất hóa học
Axit S loãng và S đặc có những tính chất hóa học khác nhau.
a. Tính chất hóa học của axit S loãng: S loãng có đầy đủ tính chất của một axit mạnh.
- Làm đổi màu quỳ tím thành đỏ
- Tác dụng với nhiều kim loại (Mg, Al, Zn, Fe,...) tạo thành muối sunfat và giải phóng khí hiđro.
Ví dụ:
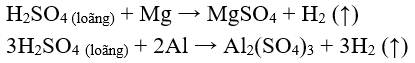
Chú ý: Các kim loại Hg, Cu, Ag, Au, Pt …không tác dụng với S loãng.
Khi Fe tác dụng với S loãng, sản phẩm thu được là muối sắt (II)
S (loãng) + Fe → FeS + (↑)
- Tác dụng với bazơ tạo thành muối sunfat và nước.
Ví dụ:
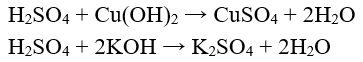
- Tác dụng với oxit bazơ tạo thành muối sunfat và nước.
Ví dụ:
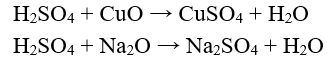
- Tác dụng với một số muối tạo thành muối sunfat và axit mới
Ví dụ:
MgC + S → MgS + C ↑ + O
b. Axit S đặc có tính chất hóa học riêng
- Tác dụng với kim loại
Axit S đặc, nóng tác dụng với nhiều kim loại tạo thành muối sunfat (ứng với hóa trị cao của kim loại nếu kim loại có nhiều hóa trị) và khí sunfurơ (không giải phóng khí hiđro).
Ví dụ:
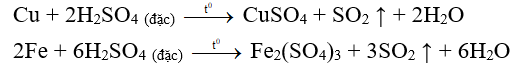

Hình 4: Phản ứng của Cu với S
- Tính háo nước
Axit sunfuric đặc chiếm nước kết tinh của nhiều muối ngậm nước, hoặc chiếm các nguyên tố H và O (thành phần của nước) trong nhiều hợp chất.
Ví dụ:
Khi cho axit S đặc vào đường, đường sẽ hóa thành than.
![]()
Sau đó một phần C sinh ra lại bị H2SO4 đặc oxi hóa:

Hình 5: S đặc tác dụng với đường.
3. Ứng dụng
Hàng năm, thế giới sản xuất gần 200 triệu tấn axit S .
Axit S là nguyên liệu của nhiều ngành sản xuất như sản xuất phân bón, phẩm nhuộm, chế biến dầu mỏ,..
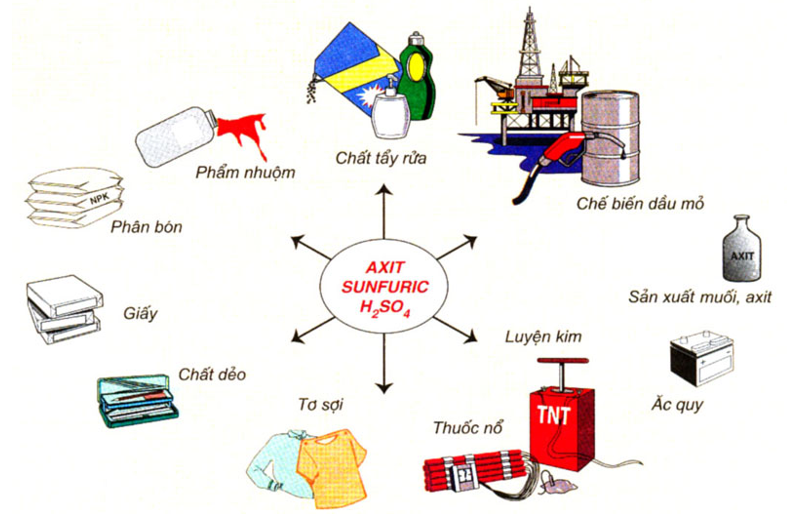
Hình 6: Sơ đồ về một số ứng dụng của axit sunfuric
4. Sản xuất axit S
Trong công nghiệp, axit sunfuric được sản xuất bằng phương pháp tiếp xúc. Nguyên liệu là lưu huỳnh (hoặc quặng pirit sắt), không khí và nước.
Quá trình sản xuất axit S gồm 3 công đoạn sau:
- Sản xuất lưu huỳnh đioxit bằng cách đốt lưu huỳnh hoặc pirit sắt trong không khí;
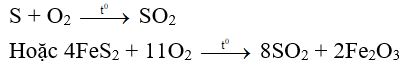
- Sản xuất lưu huỳnh trioxit bằng cách oxi hóa S, có xúc tác là ở 450C
2S+ 2S
Sản xuất axit S bằng cách cho S tác dụng với nước:
S+ O → S
5. Nhận biết axit S và muối sunfat
- Để nhận ra axit S và dung dịch muối sunfat ta dùng thuốc thử là dung dịch muối bari (như Ba; Ba(N)2 …). Phản ứng tạo thành kết tủa trắng BaS không tan trong nước và trong axit.

Hình 7: Kết tủa trắng BaS
- Phương trình hóa học:
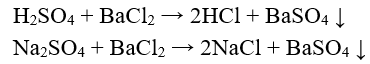
Chú ý: Để phân biệt axit sunfuric và muối sunfat, ta có thể dùng một số kim loại như Mg, Zn, Al, Fe …