Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết
-
9417 lượt thi
-
23 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
1. Cho cấu tạo lớp vỏ electron của nguyên tử thuộc các nguyên tố kí hiệu X1, X2, X3, X4, X5 như sau:
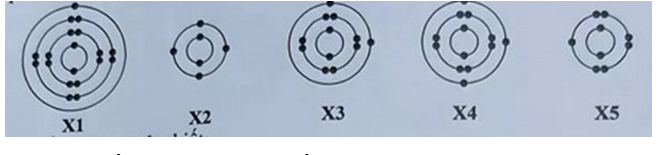
Trong số các nguyên tố trên, hãy cho biết:
a) Nguyên tố nào thuộc nhóm II của bảng tuần hoàn các nguyên tố hóa học?
 Xem đáp án
Xem đáp án
a) Nguyên tố thuộc nhóm II của bảng tuần hoàn các nguyên tố hóa học: X3 (vì có 2 electron ở lớp ngoài cùng)
Câu 2:
b) Nguyên tố nào có 13 proton ở hạt nhân nguyên tử?
 Xem đáp án
Xem đáp án
b) Nguyên tố có 13 proton ở hạt nhân nguyên tử: X4 (vì lớp vỏ có 13 electron)
Câu 3:
c) Nguyên tố nào phản ứng với kim loại kiềm theo tỉ lệ mol 1:1?
 Xem đáp án
Xem đáp án
c) Nguyên tố phản ứng với kim loại kiềm theo tỉ lệ mol 1:1: X5 (vì có 7 electron lớp ngoài cùng)
Câu 4:
 Xem đáp án
Xem đáp án
d) Nguyên tố ở chu kì 4, nhóm I: X1 (vì có 1 electron ở lớp ngoài cùng)
Câu 5:
2. Viết các phương trình phản ứng xảy ra trong các thí nghiệm sau:
a) Cho dung dịch Na2CO3 vào dung dịch AlCl3, thu được kết tủa trắng và khí thoát ra.
 Xem đáp án
Xem đáp án
2.
Các phương trình phản ứng xảy ra:
a) Cho dung dịch Na2CO3 vào dung dịch AlCl3, thu được kết tủa trắng (Al(OH)3) và khí thoát ra (CO2):
3Na2CO3 + 2AlCl3 + 3H2O ® 6NaCl + 2Al(OH)3¯ + 3CO2
Câu 6:
 Xem đáp án
Xem đáp án
b) Hòa tan hoàn toàn MgO trong dung dịch NH4Cl đặc thấy thoát khí mùi khai (NH3):
MgO + 2NH4Cl ® MgCl2 + 2NH3 + H2O
Câu 7:
3. Trình bày phương pháp hóa học để làm sạch:
a) Khí CO2 có lẫn tạp chất SO2.
 Xem đáp án
Xem đáp án
3.
a) Làm sạch khí CO2 có lẫn tạp chất SO2:
Dẫn hỗn hợp đi qua dung dịch nước brom dư, khí SO2 có phản ứng nên bị giữ lại, còn CO2 không phản ứng nên thoát ra, thu lấy khí CO2 tinh khiết bằng phương pháp dời chỗ không khí:
SO2 + Br2 + H2O ® 2HBr + H2SO4
Câu 8:
 Xem đáp án
Xem đáp án
b) Làm sạch khí H2S có lẫn tạp chất HCl:
Dẫn hỗn hợp đi qua dung dịch NaHS dư, khí HCl bị giữ lại, còn H2S không phản ứng nên thoát ra, thu lấy khí H2S tinh khiết bằng phương pháp dời chỗ không khí:
NaHS + HCl ® NaCl + H2S
Câu 9:
4. Tinh thể muối ngậm nước FeSO4.xH2O được điều chế bằng cách cho lượng dư muối sắt(II) cacbonat phản ứng với dung dịch axit sunfuric loãng theo quy trình sau: Thêm từng lượng nhỏ sắt(II) cacbonat đến dư vào dung dịch axit sunfuric loãng. Sau đó, lọc hỗn hợp phản ứng để thu lấy dung dịch. Đun nóng dung dịch đến khi thu được dung dịch bão hòa rồi để nguội. Lọc thu lấy tinh thể chất rắn và thấm khô bằng giấy lọc.
a) Tại sao phải dùng lượng dư sắt(II) cacbonat?
 Xem đáp án
Xem đáp án
Phương trình phản ứng xảy ra:
FeCO3 + H2SO4 ® FeSO4 + CO2 + H2O
a) Phải dùng lượng dư sắt(II) cacbonat vì FeSO4 rất dễ tác dụng với oxi của không khí, nên sẽ không thu được sản phẩm mong muốn:
4FeSO4 + 2H2SO4 + 2O2 ® 2Fe2(SO4)3 + 2H2O
Câu 10:
b) Hãy chỉ ra dấu hiệu cho thấy lượng sắt(II) cacbonat đã dư.
 Xem đáp án
Xem đáp án
b) Dấu hiệu cho thấy lượng sắt(II) cacbonat đã dư: Không còn thấy bọt khí thoát ra nữa chứng tỏ muối cacbonat đã hết.
Câu 11:
c) Hãy cho biết hóa chất nào có thể thay thế sắt(II) cacbonat trong quy trình trên.
 Xem đáp án
Xem đáp án
c) Có thể thay thế sắt(II) cacbonat trong quy trình trên bằng sắt: FeSO3, FeS.
Câu 12:
 Xem đáp án
Xem đáp án
d) Xác định x:
%mFe = = 20,14% Þ x = 7.
Vậy muối là FeSO4.7H2O.
Câu 13:
1. A1 và A2 là hợp chất của Na, trong phân tử chỉ chứa hai nguyên tố và đều có hàm lượng Na là 58,97% theo khối lượng. A1 là chất khử mạnh còn A2 là chất oxi hóa mạnh. A1 phản ứng với dung dịch KMnO4 trong H2SO4 loãng tạo nên chất rắn màu vàng nhạt B1. Phản ứng tương tự của A2 với KMnO4 tạo nên khí không màu B2. Biết B1 và B2 là đơn chất của hai nguyên tố cùng nhóm trong bảng tuần hoàn các nguyên tố hóa học.
a) Xác định A1, A2, B1, B2 và viết các phương trình phản ứng.
 Xem đáp án
Xem đáp án
1.
a) Xác định A1, A2, B1, B2:
- A1 là hợp chất của Na, trong phân tử chỉ chứa hai nguyên tố; có hàm lượng Na là 58,97% theo khối lượng; A1 là chất khử mạnh, phản ứng với dung dịch KMnO4 trong H2SO4 loãng tạo nên chất rắn màu vàng nhạt B1
Þ A1 là Na2S; chất rắn màu vàng B1 là S.
- A2 là hợp chất của Na, trong phân tử cũng chứa hai nguyên tố và có hàm lượng Na cũng là 58,97% theo khối lượng. A2 là chất oxi hóa mạnh, phản ứng của A2 với KMnO4 tạo nên khí không màu B2. Mà B1 và B2 là đơn chất của hai nguyên tố cùng nhóm trong bảng tuần hoàn các nguyên tố hóa học.
Þ A2 là Na2O2, B2 là O2.
- Các phương trình hóa học xảy ra:
5Na2S + 2KMnO4 + 8H2SO4 ® 2MnSO4 + 5S + K2SO4 + 5Na2SO4 + 8H2O
5Na2O2 + 2KMnO4 + 8H2SO4 ® 2MnSO4 + 5O2 + K2SO4 + 5Na2SO4 + 8H2O
Câu 14:
b) Tìm các chất từ C1 đến C5 và D1 đến D4 trong sơ đồ chuyển hóa sau. (Không cần viết phương trình phản ứng)
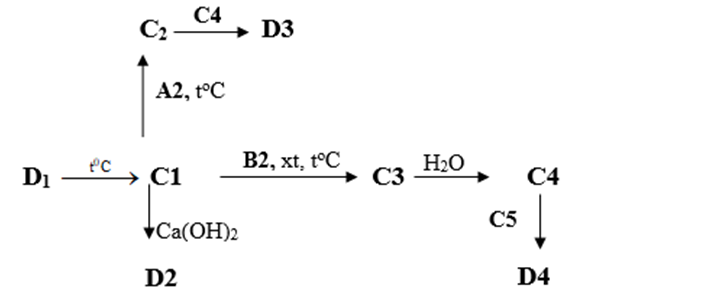
Cho biết các hợp chất từ D1, D2, D3 và D4 đều có 1 nguyên tử S trong công thức hóa học và đều có hàm lượng S là 26,67% theo khối lượng.
 Xem đáp án
Xem đáp án
b) Các chất từ C1 đến C5 và D1 đến D4 trong sơ đồ chuyển hóa:
|
C1 |
C2 |
C3 |
C4 |
C5 |
|
SO2 |
Na2SO3 |
SO3 |
H2SO4 |
|
|
D1 |
D2 |
D3 |
D4 |
|
CaSO3 |
KHSO3 |
NaHSO4 |
MgSO4 |
Câu 15:
2. Cho 12,8 gam bột lưu huỳnh phản ứng với 41,4 gam K2CO3 ở nhiệt độ cao thu được 6,72 lít khí E1 (ở đktc) và hỗn hợp rắn X chỉ gồm hai muối E2 và E3. Biết muối E2 và nguyên tố kali lần lượt chiếm 53,66% và 57,07% khối lượng của X. Muối E2 tạo nên từ hai nguyên tố. Khối lượng mol của E3 nhỏ hơn 200 g/mol.
Xác định E1, E2, E3 và viết phương trình phản ứng xảy ra.
 Xem đáp án
Xem đáp án
2.
E1 là CO2;
- Bảo toàn khối lượng ta có: mX = 12,8 + 41,4 - 0,3´44 = 41 gam
- Trong muối E2, E3 có chứa nguyên tố S.
Muối E2 tạo nên từ hai nguyên tố Þ E2 là K2S.
Vì muối E2 chiếm 53,66% khối lượng của X nên:
mE3 = 41 – 21,9596 = 19,0404 gam.
Þ Công thức phân tử E3 có dạng (K2S2O3)n
Theo bài ra ME3 < 200 g/mol nên E3 có công thức phân tử là K2S2O3.
- Phương trình hóa học:
4S + 3K2CO3 2K2S + K2S2O3 + 3CO2
Câu 16:
Thêm từ từ dung dịch Y chứa AlCl3 0,3 M và HCl 0,2 M vào 100 ml dung dịch NaOH 1,54 M. Tính thể tích dung dịch Y trong các trường hợp sau:
a) Kết tủa trắng bắt đầu xuất hiện.
 Xem đáp án
Xem đáp án
Gọi thể tích dung dịch Y cần lấy là V (lít), ta có:
nNaOH = 0,154 (mol)
Các phản ứng hóa học có thể xảy ra:
HCl + NaOH NaCl + H2O (1)
AlCl3 + 4NaOH NaAlO2 + H2O + 3NaCl (2)
AlCl3 + 3NaAlO2 + 6H2O Al(OH)3↓ + 3NaCl (3)
HCl + NaAlO2 + H2O Al(OH)3↓ + NaCl (4)
3HCl + Al(OH)3 AlCl3 + 3H2O (5)
Trong đó (1), (2) đồng thời; khi hết NaOH thì đến (3), (4) đồng thời; khi hết NaAlO2 thì đến (5).
a) Kết tủa trắng bắt đầu xuất hiện khi (1), (2) kết thúc
0,3V ´ 4 + 0,2V = 0,154 Þ V = 0,11 (lít)
Câu 17:
b) Lượng kết tủa trắng lớn nhất.
 Xem đáp án
Xem đáp án
b) Lượng kết tủa trắng lớn nhất khi (3), (4) kết thúc
Þ 0,3V ´ 3 + 0,2V = 0,154 Þ V = 0,14 (lít)
Câu 18:
 Xem đáp án
Xem đáp án
c)
TH1: Chưa có (5):
Vậy: Vdung dịch Y = 0,11 + 0,015 = 0,125 (lít).
TH2: Đã có (5):
(5) Þ nHCl = 0,063 (mol) Þ V = 0,14 + = 0,455 (lít).
Câu 19:
1. Tương tự như metan, các ankan (CnH2n+2) phản ứng với khí clo khi chiếu sáng tạo ra cloankan (CnH2n+2-xClx) bằng cách thay thế nguyên tử H bằng nguyên tử Cl (gọi là phản ứng clo hóa).
a) Vẽ công thức cấu tạo của các sản phẩm có công thức phân tử C3H6Cl2 từ phản ứng clo hóa C3H8.
 Xem đáp án
Xem đáp án
1.
a) Công thức cấu tạo của các sản phẩm có công thức phân tử C3H6Cl2 từ phản ứng clo hóa C3H8:
ClH2C – CHCl – CH3;
ClH2C – CH2 – CH2Cl;
CHCl2 – CH2 – CH3;
CH3 – CCl2 – CH3.
Câu 20:
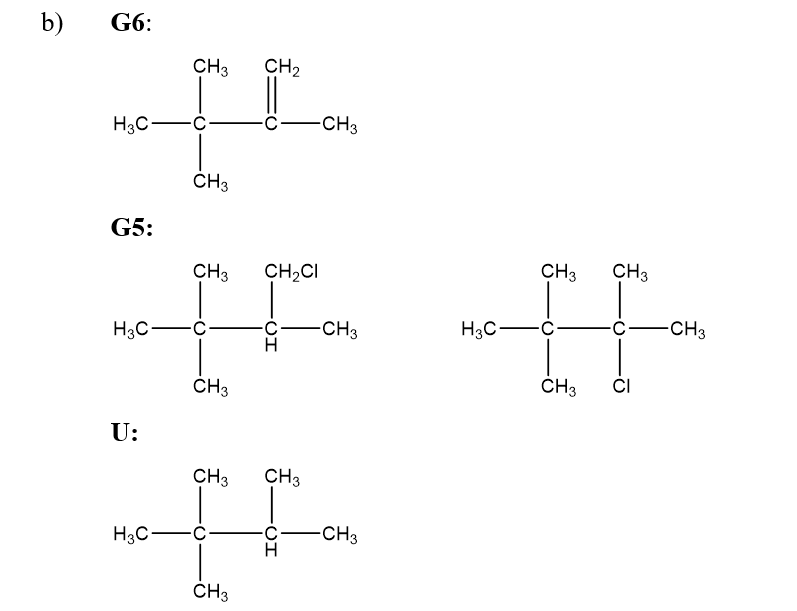
b) Khi clo hóa ankan G1 và G2 có cùng công thức phân tử C5H12, G1 chỉ cho một sản phẩm còn G2 cho ba sản phẩm đều có công thức phân tử C5H11Cl. Vẽ công thức cấu tạo của G1, G2 và các sản phẩm này.
 Xem đáp án
Xem đáp án
b)
G1:
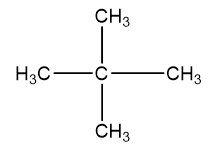
Phương trình hóa học:
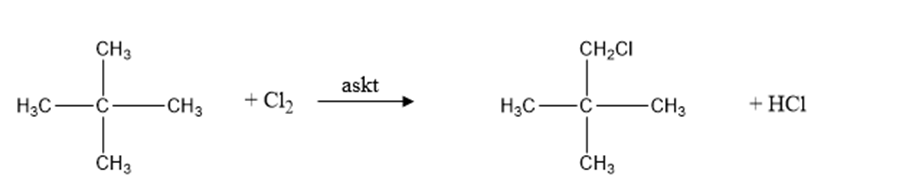
G2: CH3 - CH2 - CH2 - CH2 - CH3
Phương trình hóa học:
CH3 - CH2 - CH2 - CH2 - CH3 + Cl2
Câu 21:
2. Anken mạch hở là các hợp chất có công thức phân tử CmH2m, chứa liên kết đôi C=C trong phân tử. Dãy hợp chất này thể hiện tính chất hóa học đặc trưng tương tự etilen như phản ứng cộng Br2, phản ứng trùng hợp.
a) Quá trình “bẻ gãy” các ankan có khối lượng phân tử lớn hơn tạo thành anken và ankan có khối lượng phân tử nhỏ hơn gọi là quá trình “cracking” thường dùng trong hóa học dầu mỏ. Cracking ankan dưới đây thu được C3H8 và hai anken mạch không phân nhánh G3, G4 có cùng công thức phân tử C5H10.
- Vẽ công thức cấu tạo của hai anken G3 và G4.
- Phản ứng trùng hợp giữa hai anken G3 và G4 tạo nên polime T. Vẽ các công thức cấu tạo có thể có của đoạn mạch trong T tạo thành bởi sự liên kết một phân tử G3 và một phân tử G4 .
 Xem đáp án
Xem đáp án
a)
- Công thức cấu tạo của hai anken G3 và G4:
CH3 - CH2 - CH2 - CH = CH2 và CH3 - CH2 - CH = CH - CH3
- Phản ứng trùng hợp giữa hai anken G3 và G4 tạo thành polime T. Các công thức có thể có của đoạn mạch trong T tạo thành khi kết hợp một phân tử G3 và một phân tử G4:
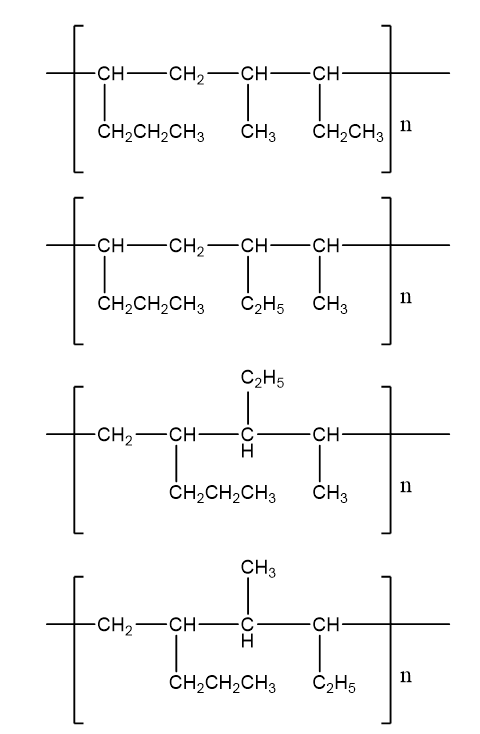
Câu 23:
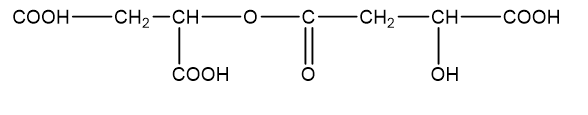
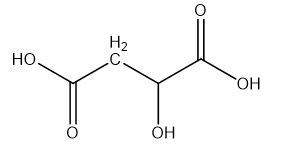
Axit malic (hình bên) có trong thành phần quả xanh như táo, nho, anh đào ... và được dùng làm chất phụ gia thực phẩm để tạo hương vị và bảo quản. Axit malic chứa hai nhóm cacboxyl và một nhóm OH trong phân tử nên thể hiện tính chất hóa học của cả ancol và axit. Khi đun nóng axit malic trong ancol etylic có mặt axit sunfuric thì thu được các chất H1, H2 và H3 trong đó H1 không làm sủi bọt dung dịch Na2CO3. H2 và H3 đều chứa 44,44% khối lượng cacbon trong phân tử. Mặt khác, đun nóng axit malic trong sự có mặt của axit sunfuric thì thu được ba sản phẩm H4, H5 và H6 đều làm sủi bọt dung dịch Na2CO3. Chất H4 (có vòng 6 cạnh) chứa 55,17% khối lượng oxi trong phân tử. H5 và H6 đều chứa 38,40% khối lượng cacbon trong phân tử. Vẽ công thức cấu tạo của các chất từ H1 đến H6.
 Xem đáp án
Xem đáp án
Axit malic:
- Khi đun nóng axit malic trong ancol etylic (C2H5OH) có mặt axit sunfuric thì thu được các chất H1, H2 và H3 trong đó H1 không làm sủi bọt dung dịch Na2CO3
Þ H1 có công thức cấu tạo là:
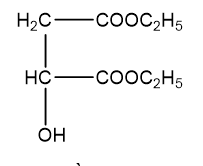
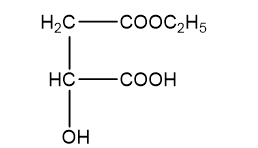
H2 và H3 đều chứa 44,44% khối lượng cacbon trong phân tử
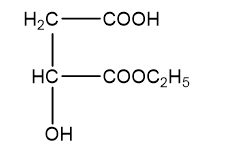
Þ Công thức phân tử của H2, H3 là C6H10O5.
Þ Công thức cấu tạo H2:
Þ Công thức cấu tạo H3:
- Đun nóng axit malic trong sự có mặt của axit sunfuric thì thu được ba sản phẩm H4, H5 và H6 đều làm sủi bọt dung dịch Na2CO3
Þ Trong phân tử H4, H5 và H6 chứa nhóm chức cacboxylic hoặc anhiđrit axit.
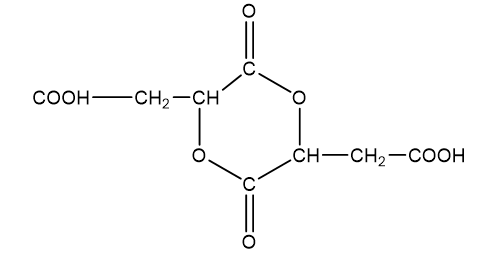
- Chất H4 (có vòng 6 cạnh) chứa 55,17% khối lượng oxi trong phân tử
Þ Công thức phân tử H4 là C8H8O8.
Þ Công thức cấu tạo H4 là:
- H5 và H6 đều chứa 38,40% khối lượng cacbon trong phân tử
Þ Công thức phân tử H5, H6 là C8H10O9.
Þ Công thức cấu tạo của H5:
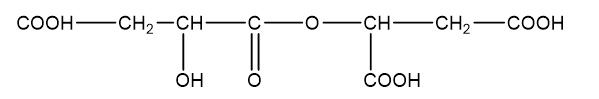
Þ Công thức cấu tạo của H6: