(4 điểm)
Hòa tan hoàn toàn 4,8 gam magie trong 200 gam dung dịch H2SO4loãng.
a. Tính thể tích khí hiđro thoát ra ở đktc.
b. Tính nồng độ phần trăm của dung dịch H2SO4cần dùng.
c. Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng.
d. Dẫn lượng khí hiđro ở trên qua 4,8 gam Fe2O3nung nóng. Tính khối lượng sắt tạo thành (Biết hiệu suất phản ứng 100%).
 Giải bởi Vietjack
Giải bởi Vietjack
a. Số mol của Mg là: nMg= = 0,2 mol
= 0,2 mol
Phương trình phản ứng:
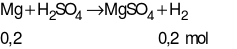
Theo phương trình phản ứng ta có: = 0,2 mol
= 0,2 mol
Suy ra thể tích khí H2thoát ra ở đktc là:
 = 0,2.22,4 = 4,48 lít
= 0,2.22,4 = 4,48 lít
b. Phương trình phản ứng:
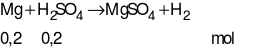
Suy ra = 0,2 mol;
= 0,2 mol; = 0,2.98 = 19,6 gam
= 0,2.98 = 19,6 gam
Vậy nồng độ phần trăm của dung dịch H2SO4cần dùng là:
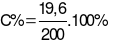 = 9,8%
= 9,8%
c. Ta có khối lượng dung dịch sau phản ứng là:
mdd sau phản ứng= 200 + 4,8 – 0,2.2 = 204,4 g
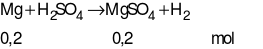
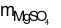 = 0,2.120 = 24 g
= 0,2.120 = 24 g
Suy ra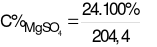 = 11,74%
= 11,74%
d. Số mol của Fe2O3là: = 0,03 mol
= 0,03 mol
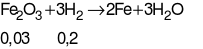
Xét tỉ lệ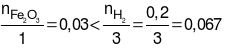
Suy ra Fe2O3hết, H2dư
Phương trình phản ứng:
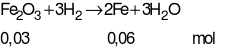
Vậy khối lượng sắt tạo thành là mFe= 0,06.56 = 3,36 gam.
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
(2,5 điểm)
Có bốn lọ dung dịch không nhãn, mỗi lọ đựng một trong các dung dịch sau: NaOH, NaNO3, HCl, Na2SO4. Hãy trình bày cách nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học (nếu có).
(2,5 điểm)
Viết phương trình hóa học cho mỗi chuyển đổi sau:
Na Na2O
Na2O NaOH
NaOH Na2CO3
Na2CO3 NaCl
NaCl NaOH.
NaOH.
(1 điểm)
Canxi oxit tiếp xúc lâu ngày với không khí sẽ bị giảm chất lượng. Hãy giải thích hiện tượng này và minh họa bằng phương trình hóa học.