Hiệu ứng nhà kính là hiện tượng Trái đất đang ấm dần lên, do các bức xạ có bước sóng dài trong vùng hồng ngoại bị giữ lại, mà không bức xạ ra ngoài vũ trụ. Chất khí nào sau đây là nguyên nhân gây ra hiệu ứng nhà kính?
A.
B.
C.
D.
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án C
Chất khí gây ra hiệu ứng nhà kính là
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Cho các chất: , HCl (6), CaO (7), đặc (8), ZnO (9), (10). Cacbon monooxit phản ứng trực tiếp được với bao nhiêu chất?
không cháy và không duy trì sự cháy nhiều chất nên được dùng để dập tắt các đám cháy. Tuy nhiên, không dùng để dập tắt đám cháy nào dưới đây?
Để phòng nhiễm độc CO, là khí không màu, không mùi, rất độc người ta sử dụng mặt nạ với chất hấp phụ là
Trong y học, hợp chất nào sau đây của natri được dùng để làm thuốc trị bệnh dạ dày :
Dẫn luồng khí CO qua hỗn hợp gồm , CuO, MgO, (nung nóng). Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn là
Phản ứng nào sau đây giải thích cho hiện tượng “Nước chảy, đá mòn” :
Khí điều chế trong phòng TN thường lẫn khí HCl và hơi nước. Để loại bỏ HCl và hơi nước ra khỏi hỗn hợp, ta dùng
Sự hình thành thạch nhũ trong các hang động đá vôi là nhờ phản ứng hoá học nào sau đây?
Baking soda còn được gọi là “thuốc muối” hay “muối nở”, thường được biết đến trong thực phẩm nhiều hơn là các công dụng khác. Thành phần của baking soda là
A – CACBON MONOOXIT
I. Cấu tạo phân tử và tính chất vật lí
- Cấu tạo của CO là C ≡ O (trong đó có 1 liên kết thuộc kiểu cho - nhận).
- CO là chất khí, không màu, không mùi, không vị, tan rất ít trong nước và rất bền với nhiệt, hóa lỏng ở -191,5C, hóa rắn ở -205,2C.
- CO là khí độc vì nó kết hợp với hemoglobin ở trong máu tạo thành hợp chất bền làm cho hemoglobin mất tác dụng vận chuyển khí .
II. Tính chất hóa học
- CO là oxit trung tính (oxit không có khả năng tạo muối) ⇒ không tác dụng với nước, dung dịch bazơ và dung dịch axit ở nhiệt độ thường.
- CO là chất khử mạnh:
+ Tác dụng với các phi kim
Thí dụ:
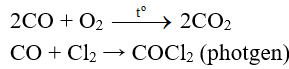
+ CO khử oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại (phản ứng xảy ra ở nhiệt độ cao).
Thí dụ:
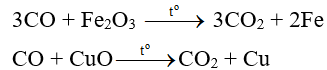
Chú ý: Dựa trên các tính chất hóa học này mà CO được ứng dụng để làm nhiên liệu khí, hay dùng trong luyện kim để khử các oxit kim loại.
III. Điều chế
1. Trong phòng thí nghiệm
- Đun nóng axit fomic (HCOOH) khi có mặt S đặc.
Phương trình hóa học:
HCOOH CO + O
2. Trong công nghiệp
- Khí CO được điều chế theo hai phương pháp:
+ Cho hơi nước đi qua than nung đỏ:
C + O CO +
⇒ Hỗn hợp khí tạo thành được gọi là khí than ướt. Ngoài CO (chiếm khoảng 44%), còn có các khí khác như C, ,…
+ Trong các lò gas, thổi không khí qua than nung đỏ:
Ở phần dưới của lò: C + C↑
Khí CO2 đi qua lớp than nung đỏ: CO2 + C 2CO
⇒ Hỗn hợp khí thu được gọi là khí lò gas (khí than khô). Trong khí lò gas, CO thường chiếm khoảng 25%, ngoài ra còn có C, ,…
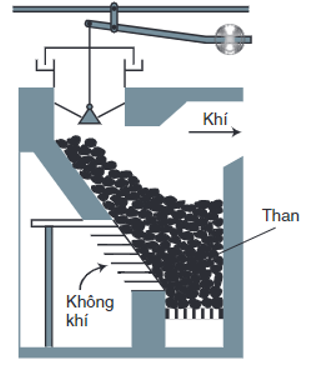
Hình 1: Sơ đồ lò gas
B – CACBON ĐIOXIT (C)
I. Cấu tạo phân tử và tính chất vật lý
1. Cấu tạo phân tử
- Cấu tạo của C là O = C = O.
- Phân tử C có cấu tạo thẳng, không phân cực.
2. Tính chất vật lý
- Là chất khí không màu, nặng gấp 1,5 lần không khí.
- Tan ít trong nước.
- C khi bị làm lạnh đột ngột chuyển sang trạng thái rắn, gọi là nước đá khô.
- Nước đá khô không nóng chảy mà thăng hoa nên được dùng để làm môi trường lạnh và khô, rất tiện lợi để bảo quản thực phẩm.

Hình 2: Đá khô
Lưu ý: Khi sử dụng đá khô phải đeo gang tay chống lạnh để tránh bị bỏng lạnh khi tiếp xúc với đá khô.
II. Tính chất hóa học
- Khí C không cháy, không duy trì sự cháy của nhiều chất.
- C là oxit axit, khi tan trong nước tạo thành axit cacbonic:
C (k) + O (l) ⇄ C (dd)
- Ngoài ra, C còn tác dụng với oxit bazơ và dung dịch kiềm.
Thí dụ:
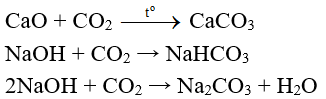
III. Điều chế
1. Trong phòng thí nghiệm
- CO2 được điều chế bằng cách cho dung dịch HCl tác dụng với đá vôi.
- Phương trình hóa học:
CaC + 2HCl → CaC + C↑ + O
2. Trong công nghiệp
- Khí C được thu hồi từ quá trình đốt cháy hoàn toàn than để cung cấp năng lượng cho các quá trình sản xuất khác.
C + C
- Ngoài ra, khí C còn được thu hồi từ quá trình chuyển hóa khí thiên nhiên, các sản phẩm dầu mỏ; quá trình nung vôi; quá trình lên men rượu từ đường glucozơ.
CaC CaO + C
2C + 2OH
C – AXIT CACBONIC VÀ MUỐI CACBONAT
I. Axit cacbonic (C)
- Là axit kém bền, chỉ tồn tại trong dung dịch loãng, dễ bị phân hủy thành C và O.
![]()
- Là axit hai nấc:
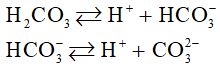
II. Muối cacbonat
Là muối của axit cacbonic (gồm muối và ).
1. Tính tan
- Muối cacbonat của các kim loại kiềm, amoni và đa số muối hiđrocacbonat dễ tan trong nước.
- Muối cacbonat của kim loại khác thì không tan.
2. Tính chất hóa học
a) Tác dụng với axit
Thí dụ:
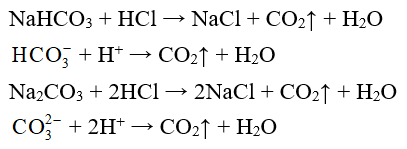
b) Tác dụng với dung dịch kiềm
- Các muối hiđrocacbonat tác dụng dễ dàng với dung dịch kiềm.
Thí dụ:
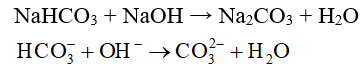
c) Phản ứng nhiệt phân
- Muối cacbonat tan không bị nhiệt phân (trừ muối amoni), muối cacbonat không tan bị nhiệt phân:
![]()
- Tất cả các muối hiđrocacbonat đều bị nhiệt phân:
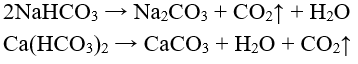
4. Ứng dụng
- Canxi cacbonat (CaC) tinh khiết là chất bột nhẹ, màu trắng, dùng làm chất độn trong cao su và 1 số ngành công nghiệp.
- Natri cacbonat (NC) khan (sođa khan) là chất bột màu trắng, tan nhiều trong nước. Dùng trong công ngiệp thủy tinh, đồ gốm, bột giặt, …
- Natri hiđrocacbonat (NaHC) là chất tinh thể màu trắng, hơi ít tan trong nước; dùng trong công nghiệp thực phẩm, trong y học dùng làm thuốc giảm đau dạ dày.