Trong phân tử anken có 8 liên kết δ. Công thức phân tử của X là
A.
B.
C.
D.
 Giải bởi Vietjack
Giải bởi Vietjack
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Khi cho but-1-en tác dụng với dung dịch HBr, theo qui tắc Mac-côp-nhi-côp sản phẩm nào sau đây là sản phẩm chính?
Hợp chất X có thành phần % khối lượng C là 85,5% và % khối lượng H là 14,5%. Hợp chất X là
Cho hình sau
Hình vẽ trên mô tả thí nghiệm điều chế khí nào sau đây?
3 hiđrocacbon X, Y, Z là đồng đẳng kế tiếp, khối lượng phân tử của Z gấp 2 lần khối lượng phân tử của X. X, Y, Z thuộc dãy đồng đẳng
I. Đồng đẳng, cấu tạo
- Anken hay olefin là những hiđrocacbon mạch hở, trong phân tử có một liên kết đôi.
- Công thức chung: CnH2n (n ≥ 2).
- Công thức anken đơn giản nhất là etilen (C = C).
II. Danh pháp, đồng phân
1. Danh pháp
* Tên thông thường = Tên ankan – an + ilen (bỏ an, thêm ilen)
Thí dụ: C = C: etilen; C = CH–C: Propilen
* Tên thay thế:
- Chọn mạch chính là mạch C dài nhất có chứa liên kết đôi.
- Đánh số C mạch chính từ phía gần liên kết đôi hơn.
Tên = vị trí nhánh – tên nhánh – tên mạch C chính – vị trí liên kết đôi – en.
Thí dụ:
C = CH – C – C: But–1–en.
C – CH = CH – C: But–2–en.
2. Đồng phân
a) Đồng phân cấu tạo
- Từ có đồng phân anken, về vị trí liên kết đôi và mạch cacbon.
Thí dụ: Đồng phân cấu tạo của anken .
C = CH – C – C
C – CH = CH – C
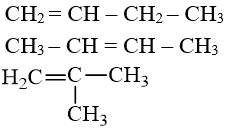
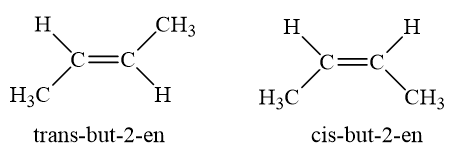
b) Đồng phân hình học
- Những anken mà mỗi nguyên tử cacbon ở vị trí liên kết đôi liên kết với hai nhóm nguyên tử khác nhau sẽ có sự phân bố trong không gian khác nhau.
⇒ Tạo ra đồng phân về vị trí không gian của các nhóm nguyên tử gọi là đồng phân hình học.
- Thí dụ: But-2-en
III. Tính chất vật lý
- Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng tăng dần khi tăng số nguyên tử cacbon trong phân tử:
- Các anken từ đến là chất khí, từ trở đi là chất lỏng hoặc chất rắn.
- Các anken đều nhẹ hơn nước và không tan trong nước.
IV. Tính chất hóa học
1. Phản ứng cộng
a) Phản ứng cộng hiđro (Phản ứng hiđro hoá)
C = C + C – C
b) Phản ứng cộng halogen (Phản ứng halogen hoá)
- Anken làm mất màu của dung dịch brom.
→ Phản ứng này dùng để nhận biết anken.
Thí dụ:
C = C + B → Br–C–C–Br
c) Phản ứng cộng HX (X là OH, Cl, Br,…)
Cộng nước
Thí dụ:
C = C + H – OH C – C – OH
Cộng axit HX
Thí dụ:
C = C + HCl → C – C – Cl
- Đối với các anken có cấu tạo không đối xứng khi tác dụng với HX có thể sinh ra hỗn hợp hai sản phẩm.
Thí dụ:
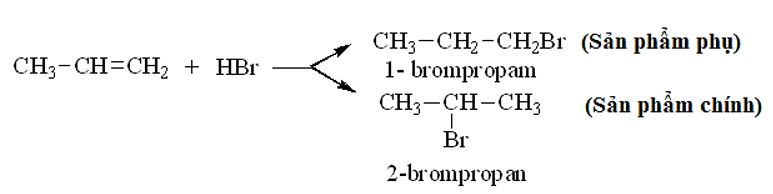
* Quy tắc Mac-côp-nhi-côp: Trong phản ứng cộng HX (axit hoặc nước) vào liên kết C = C của anken, H (phần mang điện tích dương) cộng vào C mang nhiều H hơn, X (hay phần mang điện tích âm) cộng vào C mang ít H hơn.
2. Phản ứng trùng hợp
- Phản ứng trùng hợp là quá trình kết hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau tạo thành phân tử lớn gọi là polime.
- Số lượng mắt xích trong một phân tử polime gọi là hệ số trùng hợp, kí hiệu n.
Thí dụ: Trùng hợp etilen
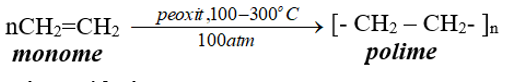
3. Phản ứng oxi hoá
a) Oxi hoá hoàn toàn
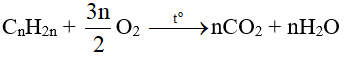
⇒ Đốt cháy hoàn toàn anken thu được
b) Oxi hoá không hoàn toàn
Anken làm mất màu dung dịch KMnO4 ⇒ Dùng để nhận biết anken.
Thí dụ:
![]()
V. Điều chế và ứng dụng
1. Điều chế
a) Trong phòng thí nghiệm
Etilen được điều chế từ ancol etylic:
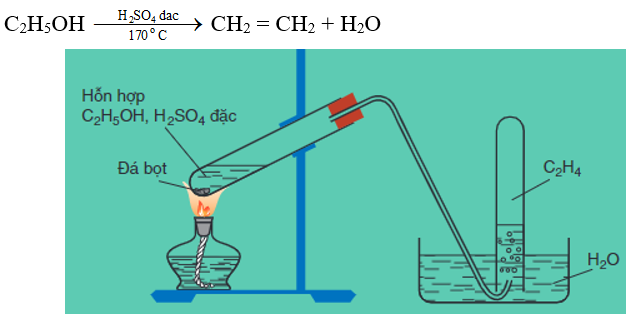
Hình 1: Điều chế etilen trong phòng thí nghiệm
b) Trong công nghiệp
Các anken được điều chế từ ankan bằng phản ứng tách hiđro:
![]()
2. Ứng dụng
- Các anken và dẫn xuất của anken là nguyên liệu cho nhiều quá trình sản xuất hóa học.
- Các anken đầu như etilen, propilen, butilen được dùng làm chất đầu tổng hợp các polime có nhiều ứng dụng.
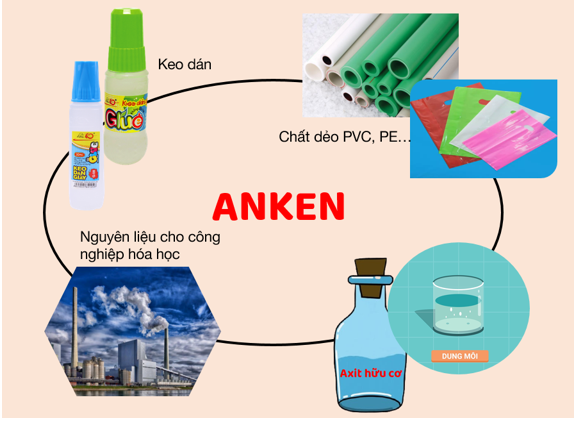
Hình 2: Một số ứng dụng của anken