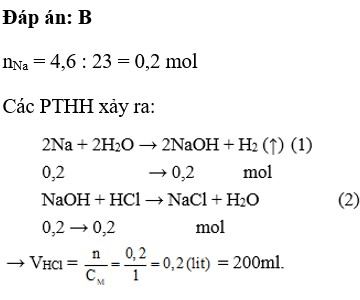
Hòa tan hết 4,6 gam Na vào H2O được dung dịch X. Thể tích dung dịch HCl 1M cần để phản ứng hết với dung dịch X là
A. 100 ml
B. 200 ml
C. 300 ml
D. 400 ml
 Giải bởi Vietjack
Giải bởi Vietjack
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Cho 0,2 mol Canxi oxit tác dụng với 500ml dung dịch HCl 1M. Khối lượng muối thu được là
Cho 21 gam tác dụng với một lượng vừa đủ dung dịch HCl 2M. Thể tích dung dịch HCl đã dùng là
Cho 10,5 gam hỗn hợp hai kim loại Zn và Cu vào dung dịch loãng dư, người ta thu được 2,24 lít khí (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là
Hòa tan vừa hết 20 gam hỗn hợp CuO và trong 200 ml dung dịch HCl 3,5M . Khối lượng mỗi oxit trong hỗn hợp là:
Chất phản ứng được với dung dịch HCl tạo ra một chất khí có mùi hắc, nặng hơn không khí và làm đục nước vôi trong là
Phản ứng giữa natri hiđroxit và axit sunfuric loãng được gọi là phản ứng
Chất tác dụng với dung dịch HCl tạo thành chất khí nhẹ hơn không khí là
Cho một khối lượng mạt sắt dư vào 500 ml dd HCl, sau phản ứng thu được 3,36 lít khí (đktc). Nồng độ mol của dung dịch HCl đã dùng là
Hòa tan hoàn toàn 5,6 gam Fe cần dùng V(ml) dung dịch HCl 2M. Giá trị của V cần tìm là:
Cho 4,8 gam kim loại magie tác dụng vừa đủ với dung dịch axit sunfuric loãng. Thể tích khí Hiđro thu được ở đktc là:
Hòa tan hoàn toàn một hiđroxit của kim loại R bằng dung dịch HCl 14,6% (vừa đủ), sau phản ứng thu được dung dịch chứa muối clorua có nồng độ 17,03%. Công thức hiđroxit của kim loại R là
I. Tính chất hóa học của axit
1. Axit làm đổi màu chất chỉ thị màu
- Dung dịch axit làm đổi màu quỳ tím thành đỏ.
- Trong hóa học, quỳ tím là chất chỉ thị màu để nhận biết dung dịch axit.
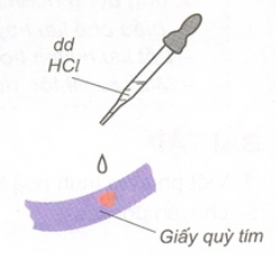
Hình 1: Dung dịch axit HCl làm quỳ tím đổi màu
2. Axit tác dụng với kim loại
- Dung dịch axit tác dụng được với nhiều kim loại tạo thành muối và giải phóng khí hiđro.
Ví dụ:
3S (dd loãng) + 2Al → (SO4)3 + 3 (↑)
Mg + 2HCl → Mg + (↑)

Hình 2: Nhôm tác dụng với S loãng
Chú ý:
- Các kim loại Hg, Cu, Ag, Au, Pt …không tác dụng với HCl, S loãng.
- Các kim loại có nhiều hóa trị như Fe, Cr … phản ứng với HCl, S loãng thu được muối, trong đó kim loại ở mức hóa trị thấp. Ví dụ:
2HCl + Fe → Fe + (↑)
- Axit HN và S đặc tác dụng được với nhiều kim loại nhưng không giải phóng khí hiđro. Ví dụ:
Cu + 2S đặc CuS + S↑ + 2O
3Cu + 8HN loãng → 3Cu(N)2 + 2NO ↑ + 4O
3. Axit tác dụng với bazơ
Tổng quát: Axit + bazơ → muối + O
Ví dụ:
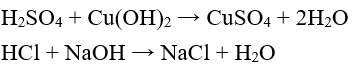
Phản ứng của axit với bazơ được gọi là phản ứng trung hòa.
4. Axit tác dụng với oxit bazơ
Tổng quát: Axit + oxit bazơ → muối + O
Ví dụ:
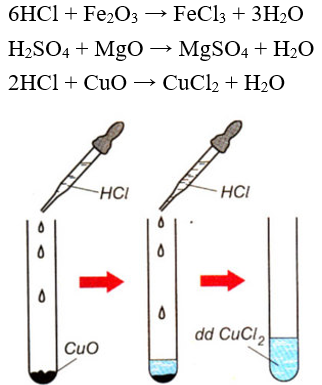
Hình 3: CuO tác dụng với HCl
5. Axit tác dụng với muối
Tổng quát: Axit + muối → axit mới + muối mới
Ví dụ:
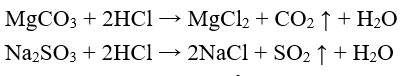
II. Axit mạnh và axit yếu
Dựa vào tính chất hóa học, axit được phân làm 2 loại:
+ Axit mạnh như HCl, S, HN,…
+ Axit yếu như S, C,…