Đốt cháy hoàn toàn 45g cacbon cần dùng V lít không khí (đktc). Biết và sản phẩm tạo thành chỉ có cacbon đioxit. Thể tích không khí cần dùng là
A. 450 lít
B. 425 lít
C. 420 lít
D. 400 lít
 Giải bởi Vietjack
Giải bởi Vietjack

Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Khối lượng C cần dùng để khử hoàn toàn 8 gam CuO thành kim loại là
Dãy oxit phản ứng với cacbon ở nhiệt độ cao tạo thành đơn chất kim loại là
Để có thể nhận biết 3 lọ mất nhãn, mỗi lọ đựng một chất rắn màu đen là: bột than, bột đồng (II) oxit và bột mangan đioxit, ta dùng
Đốt cháy hoàn toàn 12 gam C thì thể tích tối đa của khí thu được ở đktc là
Thể tích cacbon đioxit (đktc) thu được khi đốt cháy hoàn toàn 1 tấn than chứa 8% tạp chất là
I. Các dạng thù hình của cacbon
- Dạng thù hình của một nguyên tố hóa học là những đơn chất khác nhau do nguyên tố đó tạo nên.
Ví dụ: oxi (), ozon () là hai dạng thù hình của nguyên tố oxi.
- Nguyên tố cacbon có 3 dạng thù hình chính là:
+ Kim cương: cứng, trong suốt, không dẫn điện.
+ Than chì: mềm, dẫn điện.
+ Cacbon vô định hình (than đá, than gỗ, than xương, mồ hóng …): xốp, không dẫn điện.

Hình 1: Các dạng thù hình của cacbon
III. Tính chất của cacbon
1. Tính chất hấp phụ
- Than gỗ có khả năng giữ trên bề mặt của nó các chất khí, chất hơi, chất tan trong dung dịch. Than gỗ có tính hấp phụ.
- Than gỗ, than xương … mới điều chế có tính hấp phụ cao được gọi là than hoạt tính. Than hoạt tính có tính hấp phụ cao được dùng để làm trắng đường, chế tạo mặt nạ phòng độc...
2. Tính chất hóa học
Cacbon có những tính chất hóa học của phi kim. Tuy nhiên cacbon là phi kim hoạt động yếu.
Dưới đây là hai tính chất hóa học có nhiều ứng dụng trong thực tế của cacbon:
a) Tác dụng với oxi tạo thành cacbon đioxit CO2 (C là chất khử)
Phương trình hóa học: C + C
Phản ứng tỏa nhiều nhiệt, do đó C được dùng làm nhiên liệu trong sản xuất và đời sống.

Hình 2: Cacbon cháy trong khí oxi
b) Tác dụng với oxit kim loại tạo thành C và kim loại
Ở nhiệt độ cao, C khử được một số oxit kim loại như PbO, ZnO,...thành kim loại.
Ví dụ:
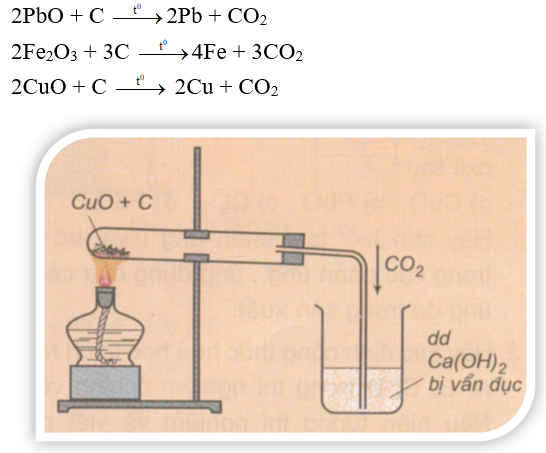
Hình 3: Phản ứng của cacbon với CuO ở nhiệt độ cao
Trong luyện kim người ta sử dụng tính chất này của cacbon để điều chế kim loại.
III. ỨNG DỤNG CỦA CACBON
Tùy thuộc vào tính chất của mỗi dạng thù hình, người ta sử dụng cacbon trong đời sống, sản xuất và trong kĩ thuật.
Ví dụ:
- Than chì được dùng làm điện cực, chất bôi trơn, ruột bút chì…

Hình 4: Một số ứng dụng của than chì
- Kim cương được dùng làm đồ trang sức quý hiếm, mũi khoan, dao cắt kính...

Hình 5: Một số ứng dụng của kim cương
- Cacbon vô định hình dùng làm mặt nạ phòng độc, chất khử mùi…

Hình 6: Một số ứng dụng của cacbon hoạt tính
- Than gỗ, than đá … được dùng làm nhiên liệu (chất đốt) trong công nghiệp, làm chất khử để điều chế một số kim loại.