Khử hoàn toàn 32 gam CuO bằng khí CO dư, thu được m gam kim loại. Giá trị của m là
A. 12,8
B. 25,6
C. 32,0
D. 16,0
 Giải bởi Vietjack
Giải bởi Vietjack
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Cho dư qua 8,14 gam hỗn hợp A gồm CuO, và nung nóng. Sau khi phản ứng xong, thu được 1,44 gam và a gam chất rắn. Giá trị của a là
Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
Cho khí CO dư đi qua ống chứa 0,2 mol MgO và 0,2 mol CuO nung nóng đến phản ứng hoàn toàn, thu được x gam chất rắn. Giá trị của x là
Cho V lít khí CO (ở đktc) phản ứng với một lượng dư hỗn hợp rắn gồm CuO và nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là
Dẫn một luồng khí CO dư qua ống sứ đựng m gam hỗn hợp và CuO nung nóng đến khi phản ứng hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 5 gam kết tủa. Giá trị của m là
Dẫn từ từ V lít khí CO (ở đktc) đi qua một ống sứ đựng lượng dư hỗn hợp rắn gồm CuO, (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X. Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch thì tạo thành 4 gam kết tủa. Giá trị của V là
Cho khí CO qua ống chứa 15,2 gam hỗn hợp A gồm CuO và FeO nung nóng. Sau một thời gian thu được hỗn hợp khí B và 13,6 gam chất rắn C. Cho B tác dụng với dung dịch dư thu được m gam kết tủa. Giá trị của m là :
Hoà tan hoàn toàn 20 gam một oxit kim loại bằng dung dịch loãng thu được 50 gam muối. Khử hoàn toàn lượng oxit đó thành kim loại ở nhiệt độ cao cần V lít khí CO (đktc). Giá trị của V là
Khử 3,48 gam một oxit của kim loại M cần dùng 1,344 lít (đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít (đktc). Công thức oxit là
Cho khí CO (dư) đi vào ống sứ nung nóng đựng hỗn hợp X gồm , MgO, , CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm:
I. Cacbon oxit
- Công thức phân tử: CO.
- Phân tử khối: 28
1. Tính chất vật lí
CO là chất khí, không màu, không mùi, hơi nhẹ hơn không khí ( ), rất độc, ít tan trong nước.
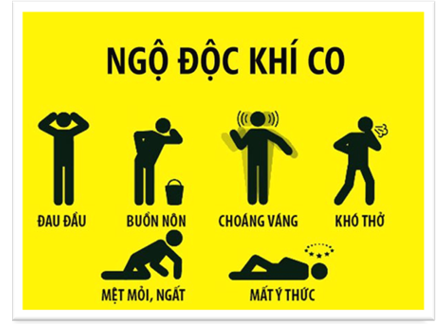
Hình 1: Biểu hiện của ngộ độc khí CO
2. Tính chất hóa học
a) CO là oxit trung tính
Ở điều kiện thường không phản ứng với nước, kiềm và axit.
b) CO là chất khử
- Ở nhiệt độ cao, cacbon oxit khử được các oxit của kim loại đứng sau nhôm trong dãy hoạt động hóa học để thu được kim loại.
Ví dụ:
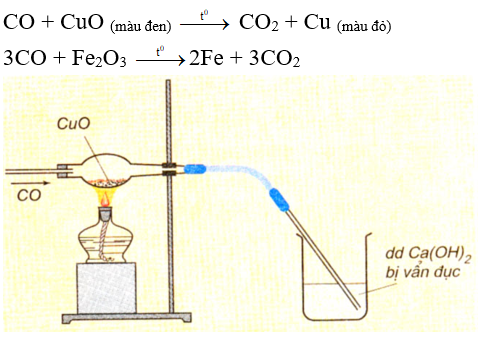
Hình 2: CO khử CuO
- CO cháy trong oxi hoặc trong không khí với ngọn lửa màu xanh, tỏa nhiều nhiệt.
Phương trình hóa học: 2CO + 2C
3. Ứng dụng
Khí CO được dùng làm nhiên liệu, chất khử… trong công nghiệp. Ngoài ra còn được dùng làm nguyên liệu trong công nghiệp hóa học.
II. Cacbon đioxit
- Công thức phân tử: C
- Phân tử khối: 44
1. Tính chất vật lí
- C là chất khí, không màu, không mùi, nặng hơn không khí ), không duy trì sự sống và sự cháy.
- C bị nén và làm lạnh thì hóa rắn được gọi là nước đá khô (tuyết cacbonic). Nước đá khô được dùng để bảo quản thực phẩm.
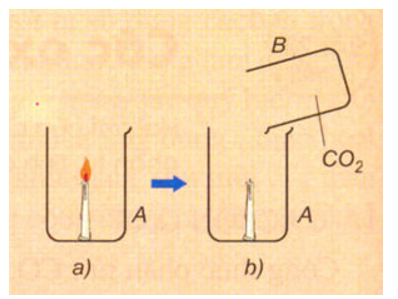
Hình 3: C không duy trì sự cháy
2. Tính chất hóa học: C là một oxit axit.
a) Tác dụng với nước tạo thành axit cacbonic
Phương trình hóa học:
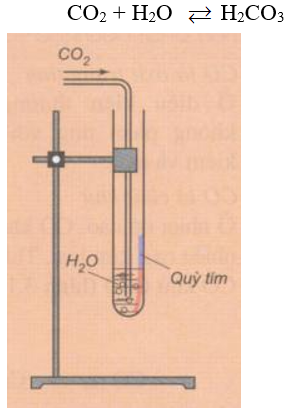
Hình 4: Khí C phản ứng với nước
Chú ý: C phản ứng với nước tạo thành dung dịch axit, làm quỳ tím chuyển sang màu đỏ. C không bền, dễ phân hủy thành C và nước, khi đun nóng dung dịch thu được sẽ lại làm quỳ màu đỏ chuyển sang màu tím.
b) Tác dụng với dung dịch bazơ
Khí CO2 tác dụng với dung dịch bazơ tạo thành muối và nước. Tùy theo tỉ lệ số mol giữa C và dung dịch bazơ mà có thể tạo ra muối trung hòa, muối axit hay hỗn hợp hai muối.
Ví dụ:
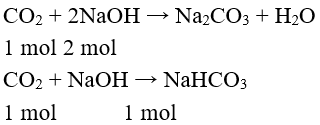
c) Tác dụng với oxit bazơ
C tác dụng với oxit bazơ (tan) tạo thành muối.
Ví dụ:
C + CaO CaC
3. Ứng dụng
C được dùng để chữa cháy, bảo quản thực phẩm.
Ngoài ra, C còn được dùng trong sản xuất nước giải khát có gas, sản xuất sođa, phân đạm,...