Có các chất rắn màu trắng, đựng trong các lọ riêng biệt không nhãn : , NaCl, NaOH. Nếu dùng quỳ tím và nước thì có thể nhận ra
A. 1 chất
B. 2 chất
C. 3 chất
D. không nhận được
 Giải bởi Vietjack
Giải bởi Vietjack
- Cho nước vào các mẫu chất rắn, mẫu không tan trong nước là , 2 mẫu tan trong nước là NaCl và NaOH
- Dùng quỳ tím để nhận biết 2 dung dịch của 2 mẫu tan, dung dịch không làm đổi màu quỳ là NaCl, dung dịch làm đổi màu quỳ là NaOH
Đáp án: C
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Hãy xác định công thức hóa học của muối natri cacbonat ngậm nước biết rằng khi nung 3,1 gam tinh thể này đến khối lượng không đổi được chất rắn có khối lượng là 2,65 gam
Quá trình thổi khí CO2 đến dư vào dung dịch NaOH, muối tạo ra theo thứ tự là :
Sự tạo thành thạch nhũ trong các hang động của mỏ đá vôi là do có phản ứng :
Hãy cho biết trong các cặp chất sau đây, cặp nào không thể tác dụng với nhau?
Tính thể tích khí (đktc) tạo thành để dập tắt đám cháy nếu trong bình chữa cháy có dung dịch chứa 980 gam tác dụng hết với dung dịch .
Có 4 chất rắn: NaCl, , , chỉ dùng thêm một cặp chất nào dưới đây để nhận biết ?
Hòa tan 14 gam hỗn hợp 2 muối và bằng dung dịch HCl dư, thu được dung dịch A và 0,672 lít khí (đktc). Cô cạn dung dịch A thu được m gam muối khan. Giá trị của m là
Cho 2,44 gam hỗn hợp muối và tác dụng vừa đủ với dung dịch 0,5M, sau phản ứng thu được 0,448 lít ở đktc. Thể tích dung dịch 0,5M cần dùng là:
Hòa tan hoàn toàn 5 gam hỗn hợp 2 muối cacbonat kim loại hóa trị I và hóa trị II bằng dung dịch HCl thu được dung dịch M và 1,12 lít khí (đktc). Khi cô cạn dung dich M thu được khối lượng muối khan là:
Cho 3,28 gam hỗn hợp 3 muối , và tác dụng vừa đủ với 60 ml dung dịch 0,5M. Thể tích khí sinh ra ở đktc là
I. Axit cacbonic (Công thức hóa học C)
1. Trạng thái tự nhiên và tính chất vật lí
- Trong nước tự nhiên và nước mưa có hòa tan khí cacbonic: 1000 m3 nước hòa tan được 90 m3 khí C.
- Một phần khí C tác dụng với nước tạo thành dung dịch axit cacbonic, phần lớn vẫn tồn tại ở dạng phân tử C
2. Tính chất hóa học
- C là một axit yếu: dung dịch C chỉ làm quỳ tím chuyển thành màu đỏ nhạt, bị axit mạnh đẩy ra khỏi muối.
- C là một axit không bền: C tạo thành trong các phản ứng hóa học bị phân hủy ngay thành C và O.
II. Muối cacbonat
1. Phân loại:
Có hai loại muối cacbonat:
- Muối cacbonat trung hòa (hay muối cacbonat), không còn nguyên tố H trong thành phần gốc axit.
Ví dụ: NC, CaC,..
- Muối cacbonat axit (hay muối hiđrocacbonat), có nguyên tố H trong thành phần gốc axit.
Ví dụ: NaHC, Ca(HC)2...
2. Tính chất
a) Tính tan:
- Đa số muối cacbonat không tan trong nước, trừ một số muối cacbonat của kim loại kiềm như NCO3, C...
- Hầu hết các muối hiđrocacbonat tan trong nước như Ca(HC)2; Mg(HC)2 …
b) Tính chất hóa học
- Tác dụng với axit:
+ Muối cacbonat tác dụng với dung dịch axit mạnh hơn axit cacbonic (như HCl, HN, H,S,...) tạo thành muối mới và giải phóng C.
+ Ví dụ:

Hình 1: NaHC tác dụng với HCl
- Tác dụng với dung dịch bazơ
+ Một số dung dịch muối cacbonat tác dụng với dung dịch bazơ tạo thành muối cacbonat không tan và bazơ mới.
+ Ví dụ:

Hình 2: C tác dụng với Ba(OH)2
+ Muối hiđrocacbonat tác dụng với dung dịch kiềm tạo thành muối trung hòa và nước
Ví dụ:
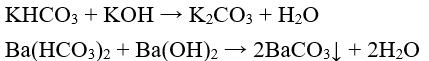
-Tác dụng với dung dịch muối
- Dung dịch muối cacbonat tác dụng với một số dung dịch muối tạo thành 2 muối mới
Ví dụ:
NC + CaC → 2NaCl + CaC↓
- Muối cacbonat bị nhiệt phân hủy
Nhiều muối cacbonat (trừ muối cacbonat trung hòa của kim loại kiềm) dễ bị nhiệt phân hủy giải phóng khí C
Ví dụ:
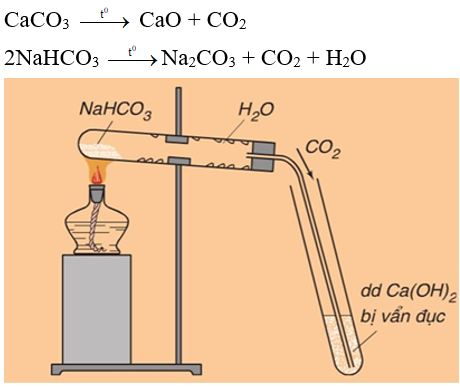
Hình 3: Nhiệt phân muối NaHC
3. Ứng dụng:
- CaC là thành phần chính của đá vôi, được dùng để sản xuất vôi, xi măng…
- NC được dùng để nấu xà phòng, sản xuất thủy tinh,..
- NaHC được dùng làm dược phẩm, hóa chất trong bình cứu hỏa,...
III. Chu trình cacbon trong tự nhiên
Trong tự nhiên luôn có sự chuyển hóa cacbon tự dạng này sang dạng khác. Sự chuyển hóa này diễn ra thường xuyên, liên tục và tạo thành chu trình khép kín.
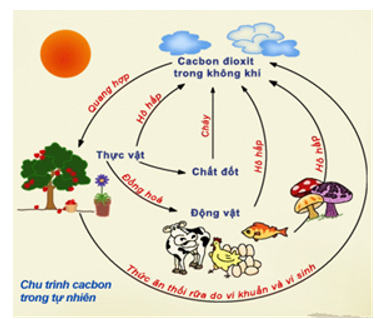
Hình 4: Chu trình cacbon trong tự nhiên