Trong 1 chu kỳ (trừ chu kì 1), đi từ trái sang phải tính chất của các nguyên tố biến đổi như sau
A. tính kim loại và tính phi kim đều giảm dần
B. tính kim loại và tính phi kim đều tăng dần
C. tính kim loại giảm dần đồng thời tính phi kim tăng dần
D. tính kim loại tăng dần đồng thời tính phi kim giảm dần
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án C
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Biết X có cấu tạo nguyên tử như sau: điện tích hạt nhân là 12+, có 3 lớp electron, lớp ngoài cùng có 2 electron. Vị trí của X trong bảng tuần hoàn là
Trong chu kỳ 3, X là nguyên tố đứng đầu chu kỳ, còn Y là nguyên tố đứng cuối chu kỳ nhưng trước khí hiếm. Nguyên tố X và Y có tính chất sau
Nguyên tử của nguyên tố X có 3 lớp electron, lớp electron ngoài cùng có 7 electron. Vị trí và tính chất cơ bản của nguyên tố X là
Nguyên tố M có số hiệu nguyên tử là 19, chu kỳ 4, nhóm I trong bảng tuần hoàn các nguyên tố hóa học. Phát biểu nào sau đây đúng
Nguyên tố X có số hiệu nguyên tử là 10. Điều khẳng định nào sau đây không đúng?
Nhóm các nguyên tố được sắp xếp theo chiều tính phi kim tăng dần là
Dãy các kim loại nào sau đây được sắp xếp theo chiều tính kim loại tăng dần
Nguyên tố X ở chu kỳ 4 nhóm VI, nguyên tố Y ở chu kỳ 2 nhóm VII. So sánh tính chất của X và Y thấy
Cho các nguyên tố sau O, P, N. Hãy chỉ ra thứ tự sắp xếp đúng theo chiều tính phi kim tăng dần
Dãy công thức hoá học của oxit tương ứng với các nguyên tố hoá học thuộc chu kì 3 là:
I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Năm 1869, nhà bác học người Nga là Đ. I. Men – đê – lê – ép đã sắp xếp khoảng 60 nguyên tố trong bảng tuần hoàn theo chiều tăng của nguyên tử khối.
- Ngày nay, bảng tuần hoàn có hơn 100 nguyên tố. Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
Ii. Cấu tạo bảng tuần hoàn
1. Ô nguyên tố
- Ô nguyên tố cho biết: Số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố đó.
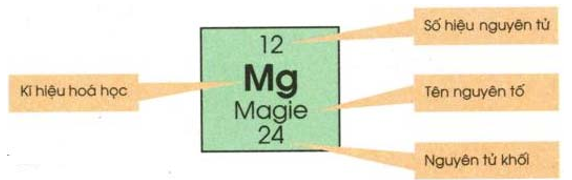
Hình 1: Ô nguyên tố magie
- Số hiệu nguyên tử có số trị bằng số đơn vị điện tích hạt nhân và bằng số electron trong nguyên tử. Số hiệu nguyên tử trùng với số thứ tự ô trong bảng tuần hoàn.
Ví dụ:
Số hiệu nguyên tử của Si là 14 cho biết: silic ở ô thứ 14 trong bảng tuần hoàn, điện tích hạt nhân nguyên tử silic là 14+ (hay số đơn vị điện tích hạt nhân là 14), có 14 electron trong nguyên tử silic.
2. Chu kì
- Chu kỳ là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được xếp theo chiều điện tích hạt nhân tăng dần.
- Số thứ tự chu kì bằng số lớp electron.
- Bảng tuần hoàn gồm có 7 chu kỳ: chu kỳ 1, 2, 3 là các chu kỳ nhỏ. Chu kỳ 4, 5, 6, 7 là các chu kỳ lớn.
Ví dụ
+) Chu kì 2: Gồm 8 nguyên tố từ Li đến Ne, có 2 lớp electron trong nguyên tử. Điện tích hạt nhân tăng dần từ Li là 3+,… đến Ne là 10+.
+) Mô phỏng cấu tạo nguyên tử O ở chu kỳ 2, có 2 lớp electron.
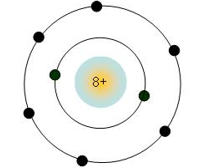
3. Nhóm
- Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau, do đó có tính chất tương tự nhau được xếp thành một cột theo chiều tăng của điện tích hạt nhân nguyên tử.
- Số thứ tự của các nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử trong nhóm đó.
Ví dụ:
+) Nhóm IA: Gồm các nguyên tố kim loại hoạt động mạnh. Nguyên tử của chúng đều có 1 electron ở lớp ngoài cùng. Điện tích hạt nhân tăng từ Li (3+), … đến Fr (87+).
+) Mô phỏng cấu tạo nguyên tử Kali ở nhóm IA, có 1 electron ở lớp ngoài cùng:
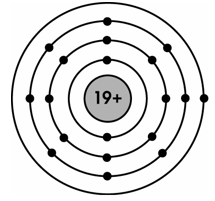
III. Sự biển đổi tính chất của các nguyên tố trong bảng tuần hoàn
1. Trong một chu kì
Trong một chu kỳ, khi đi từ đầu đến cuối chu kỳ theo chiều tăng của điện tích hạt nhân:
- Số e lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
- Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dần.
Ví dụ:
Chu kì 2 gồm 8 nguyên tố:
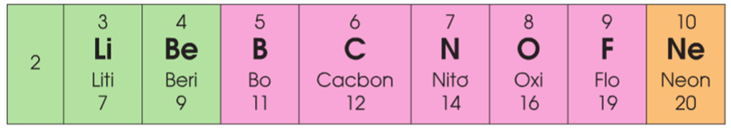
+ Số e lớp ngoài cùng của nguyên tử các nguyên tố trong chu kỳ 2 tăng dần từ 1 đến 8
+ Đẩu chu kỳ 2 là một kim loại mạnh (Li), cuối chu kỳ là một phi kim mạnh (F), kết thúc chu kỳ là một khí hiếm (Ne).
2. Trong một nhóm
Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân. - Số lớp electron của nguyên tử tăng dần.
- Tính kim loại của các nguyên tố tăng dần, đồng thời tính phi kim của các nguyên tố giảm dần.
Ví dụ:
Nhóm IA gồm 6 nguyên tố từ Li đến Fr
+) Số lớp electron tăng dần từ 2 đến 7. Số electron lớp ngoài cùng của nguyên tử đều bằng 1.
+) Tính kim loại của các nguyên tố tăng dần. Đầu nhóm IA, Li là kim loại hoạt động hóa học mạnh cuối nhóm là kim loại Fr hoạt động hóa học rất mạnh
IV. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
1. Biết vị trí của nguyên tố ta có thể suy đoán cấu tạo nguyên tử và tính chất của nguyên tố.
Ví dụ:
Biết: Nguyên tố A có số hiệu nguyên tử là 17, chu kì 3, nhóm VIIA.
Xác định được:
+) Nguyên tố A có số hiệu nguyên tử là 17, suy ra điện tích hạt nhân của nguyên tử A là 17+, nguyên tử A có 17 electron.
+) A ở chu kì 3, suy ra nguyên tử A có 3 lớp electron. Vì ở gần cuối chu kì 3 nên A là một phi kim mạnh, tính phi kim của A mạnh hơn của nguyên tố trước nó trong cùng chu kì (là S có số hiệu là 16).
+) A ở nhóm VIIA nên lớp ngoài cùng có 7 electron, tính phi kim của A yếu hơn của nguyên tố phía trên nó trong cùng nhóm (là F có số hiệu nguyên tử là 9) nhưng mạnh hơn nguyên tố đứng dưới nó trong cùng nhóm (là Br có số hiệu nguyên tử là 35).
2. Biết cấu tạo nguyên tử của nguyên tố có thể suy đoán vị trí và tính chất nguyên tố đó.
Ví dụ:
Biết: Nguyên tố X có điện tích hạt nhân là 11+, nguyên tử X có 3 lớp electron, lớp ngoài cùng có 1 electron.
Xác định được:
+ Nguyên tử X có điện tích hạt nhân là 11+ suy ra X ở ô 11
+ Nguyên tử X có 3 lớp electron nên X ở chu kỳ 3
+ Nguyên tử X có 1e ở lớp ngoài cùng nên X ở nhóm IA.
- Nguyên tố X là kim loại vì ở đầu chu kì
Tổng kết: Biết vị trí của nguyên tố trong bảng tuần hoàn ta có thể suy đoán cấu tạo nguyên tử và ngược lại.
