Viết phương trình dạng phân tử và ion rút gọn của các phản ứng trong dung dịch theo sơ đồ sau:
 Giải bởi Vietjack
Giải bởi Vietjack
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Viết phương trình dạng phân tử ứng với phương trình ion rút gọn sau:
Dung dịch axit mạnh 0,10M có :
A. pH = 1.
B. pH < 1.
C. pH > 1.
D. [] > 0,2M.
Dung dịch axit mạnh một nấc X nồng độ 0,010 mol/l có pH = 2 và dung dịch bazơ mạnh một nấc Y nồng độ 0,010 mol/l có pH = 12. Vậy:
A. X và Y là các chất điện li mạnh.
B. X và Y là các chất điện li yếu.
C. X là chất điện li mạnh, Y là chất điện li yếu.
D. X là chất điện li yếu, Y là chất điện li mạnh.
Một mẫu nước mưa có pH = 5,12. Vậy nồng độ trong đó là :
A. [] = 1.M.
B. [] = 1.M.
C. [] > 1.M.
D. [] < 1.M.
Hoà tan hoàn toàn 0,12 g Mg trong 100,0 ml dung dịch HCl 0,20 M. Tính pH của dung dịch sau khi phản ứng kết thúc (thể tích dung dịch biến đổi không đáng kể).
Dung dịch chất A có pH = 3. Cần thêm V2 ml nước vào V1 ml dung dịch chất A để pha loãng thành dung dịch có pH = 4. Biểu thức liên hệ giữa V1 và V2 là
A. V2 = 9V1
B. V2 = 10V1
C. V1 = 9V2
D. V2 = V1/10
Nồng độ trong rượu vang là 3,2.M. Sau khi mở nút chai để hở trong không khí một tháng, nồng độ là 1.M. Hỏi pH của rượu vang tăng lên hay giảm xuống sau khi để trong không khí ?
Có 6 dung dịch đựng trong 6 lọ mất nhãn : Mg, Zn, Pb, Al, KOH và NaCl. Chỉ dùng thêm dung dịch và một thuốc thử nữa, hãy trình bày cách nhận biết từng dung dịch. Viết các phương trình hoá học dưới dạng phân tử và ion rút gọn của các phản ứng nhận biết đó.
Trong nước biển, magie là kim loại có hàm lượng lớn thứ hai sau natri. Mỗi kilogam nước biển chứa khoảng 1,3 g magie dưới dạng các ion . Ở nhiều quốc gia, magie được khai thác từ nước biển. Quá trình sản xuất magie từ nước biển gồm các giai đoạn sau :
1. Nung đá vôi thành vôi sống.
2. Hoà tan vôi sống trong nước biển tạo ra kết tủa .
3. Hoà tan kết tủa trong dung dịch HCl.
4. Điện phân nóng chảy:
Viết các phương trình hoá học dưới dạng phân tử và ion rút gọn (nếu có) của quá trình sản xuất trên.
Nước chứa nhiểu ion và là nước cứng. Nước chứa ít hoặc không chứa các ion và là nước mềm.Để loại các ion và dưới dạng Ca, Mg và Mg(người ta cho sữa vôi vào nước sẽ tạo ra các kết tủa va Để loại dưới dạng Ca người ta hoà tan vào nước sẽ tạo kết tủa .Hãy viết các phương trình hoá học dưới dạng phân tử và ion rút gọn của các phản ứng trên.
Kiến thức trọng tâm
1. Axit - Bazơ
- Theo A-rê-ni-ut, thì:
+ Axit là chất tan trong nước phân li ra ion H+.
Thí dụ: HCl → H+ + Cl-
+ Bazơ khi tan trong nước phân li ra ion OH-.
Thí dụ: KOH → K+ + OH-
2. Hiđroxit lưỡng tính
- Hiđroxit lưỡng tính khi tan trong nước vừa phân li như axit, vừa có thể phân li như bazơ.
Thí dụ: Zn, Al, Pb, Sn, Cr, …
Phương trình hóa học minh họa:
3. Muối
- Hầu hết các muối khi tan trong nước phân li hoàn toàn ra cation kim loại (hoặc ) và anion gốc axit.
FeC → F+ + 2Cl-
- Nếu gốc axit còn chứa hiđro có tính axit, thì gốc đó tiếp tục phân li yếu ra cation H+ và anion gốc axit.
Thí dụ:
NaHS → Na+ + HS-
4. Tích số ion của nước
= [H+].[OH-] = 10^-14 M (ở 25C). Một cách gần đúng, có thể coi giá trị của tích số này là hằng số cả trong dung dịch loãng của các chất khác nhau.
5. Ý nghĩa giá trị [H+] và pH
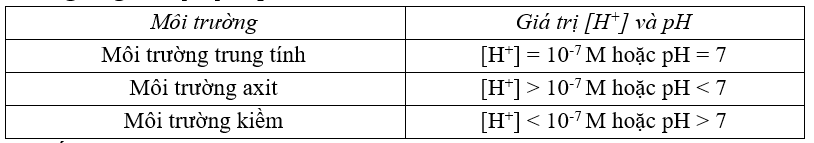
6. Chất chỉ thị
Các chất chỉ thị thường dùng: quỳ tím, phenolphtalein và chất chỉ thị vạn năng.
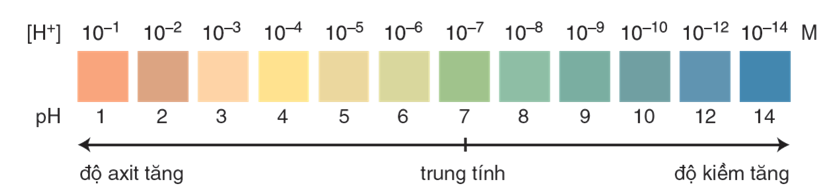
Hình 1: Màu của chất chỉ thị vạn năng thay đổi theo pH của dung dịch
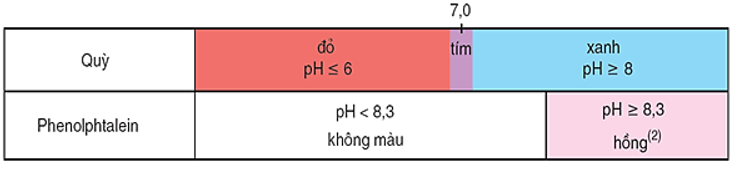
Hình 2: Màu của quỳ và phenolphtalein trong dung dịch ở các khoảng pH khác nhau
7. Phản ứng trao đổi ion
Phản ứng trao đổi ion trong dung dịch chất điện li chỉ xảy ra khi các ion kết hợp với nhau tạo thành ít nhất một trong các chất sau:
- chất kết tủa.
- chất điện li yếu.
- chất khí.
Thí dụ:
NS + BaC → 2NaCl + BaS↓
HCl + NaOH → NaCl + O
Fe + S loãng → FeS + ↑
8. Phương trình ion rút gọn
- Cho biết bản chất của phản ứng trong dung dịch các chất điện li.
- Trong phương trình ion rút gọn, loại bỏ những ion không tham gia phản ứng, còn những chất kết tủa, chất khí, chất điện li yếu được giữ nguyên dưới dạng phân tử.
Thí dụ:
Phương trình phân tử:
Zn + 2HCl → ZnC + ↑
Phương trình ion rút gọn: