Bài tập Nguyên tử có đáp án
-
169 lượt thi
-
11 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Mọi vật thể tự nhiên hay nhân tạo đều được tạo thành từ một số loại hạt vô cùng nhỏ bé gọi là nguyên tử. Vậy nguyên tử có cấu tạo như thế nào?
 Xem đáp án
Xem đáp án
Nguyên tử gồm hạt nhân mang điện tích dương và vỏ mang điện tích âm.
+ Hạt nhân nguyên tử tạo thành từ các hạt proton và neutron.
+ Vỏ nguyên tử được tạo bởi các electron.
Câu 2:
Theo Đê-mô-crit và Đan-tơn, nguyên tử được quan niệm như thế nào?
 Xem đáp án
Xem đáp án
- Đê-mô-crit đã cho rằng: nguyên tử là một loại hạt vô cùng nhỏ tạo nên sự đa dạng của vạn vật. Khởi nguồn của quan niệm nguyên tử là sự chia nhỏ một vật sẽ đến một giới hạn “không thể phân chia được”.
- Theo Đan-tơn, nguyên tử là các đơn vị chất tối thiểu.
Câu 3:
Làm mô hình nguyên tử carbon theo Bo
Chuẩn bị: bìa carton, giấy màu vàng, các viên bi nhựa to màu đỏ và các viên bi nhỏ màu xanh.
Tiến hành:
Gắn viên bi đỏ vào bìa carton làm hạt nhân nguyên tử carbon.
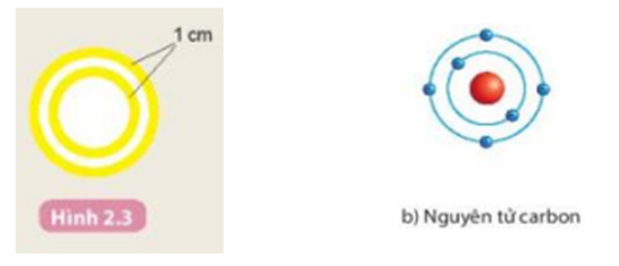
Cắt giấy màu vàng thành hai đường tròn có bán kính khác nhau và mỗi vòng tròn có độ dày khoảng 1 cm (Hình 2.3). Dán các đường tròn lên bìa carton sao cho tâm của hai đường tròn là viên bi đỏ.
Gắn các viên bi màu xanh lên hai đường tròn màu vàng như Hình 2.2b.
Thảo luận nhóm và trả lời câu hỏi:
1. Các đường tròn bằng giấy màu vàng biểu diễn gì?
2. Em hãy cho biết số electron có trong lớp electron thứ nhất và thứ hai của nguyên tử carbon và chỉ ra lớp electron đã chứa tối đa electron.
 Xem đáp án
Xem đáp án
1. Các đường tròn bằng giấy màu vàng biểu diễn lớp electron.
2. Lớp electron thứ nhất của nguyên tử carbon chứa 2 electron.
Lớp electron thứ hai của nguyên tử carbon chứa 4 electron.
⇒ Lớp electron thứ nhất đã chứa tối đa electron.
Câu 4:
Quan sát Hình 2.1 và cho biết các thành phần cấu tạo nên nguyên tử.
 Xem đáp án
Xem đáp án
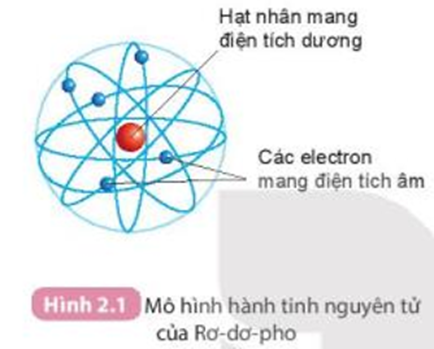
Dựa vào Hình 2.1, ta thấy: Nguyên tử được cấu tạo bởi hạt nhân mang điện tích dương và các electron mang điện tích âm chuyển động quanh hạt nhân.
Câu 5:
 Xem đáp án
Xem đáp án
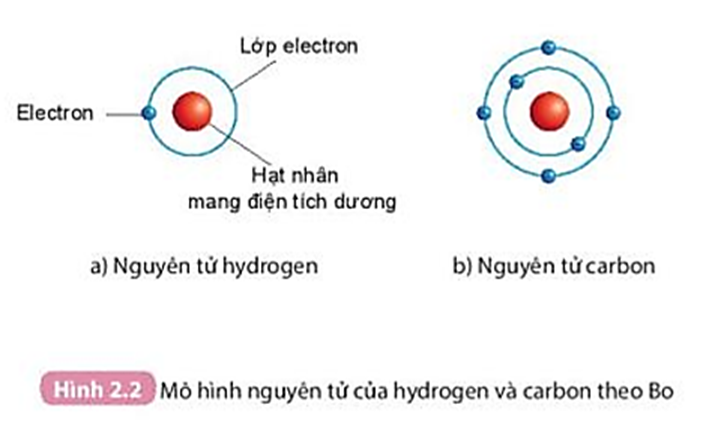
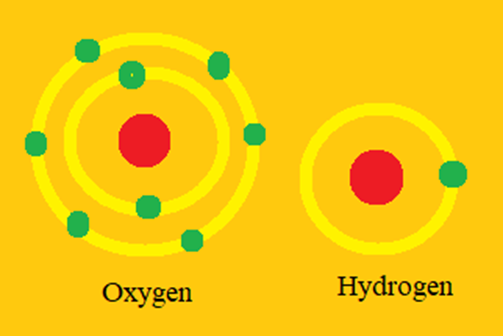
- Nguyên tử hydrogen gồm có hạt nhân mang điện tích dương và 1 electron chuyển động quanh hạt nhân.
- Nguyên tử carbon gồm có hạt nhân mang điện tích dương và 6 electron chuyển động quanh hạt nhân. 6 electron này được xếp thành hai lớp, lớp trong cùng có 2 electron, lớp tiếp theo có 4 electron.
Câu 6:
Quan sát Hình 2.4 và cho biết:
1. Hạt nhân nguyên tử có một hay nhiều hạt? Các hạt đó thuộc cùng một loại hạt hay nhiều loại hạt?
2. Số đơn vị điện tích hạt nhân của helium bằng bao nhiêu?
 Xem đáp án
Xem đáp án
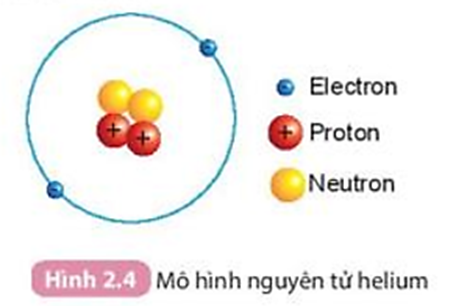
1. Hạt nhân nguyên tử có nhiều hạt. Các hạt này thuộc hai loại hạt là proton và neutron.
2. Số đơn vị điện tích hạt nhân của helium bằng 2 (bằng tổng số proton trong hạt nhân).
Câu 7:
Chuẩn bị: Mô hình nguyên tử của các nguyên tử carbon, nitrogen, oxygen theo Hình 2.5.
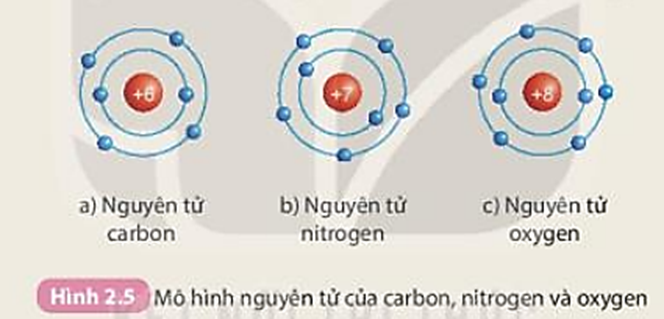
Quan sát các mô hình nguyên tử đã chuẩn bị, thảo luận nhóm, hoàn thành bảng theo mẫu sau và trả lời các câu hỏi:
Bảng 2.1.
|
Nguyên tử |
Số proton trong hạt nhân |
Số electron trong vỏ nguyên tử |
Số lớp electron |
Số electron ở lớp electron ngoài cùng |
|
Carbon |
? |
? |
? |
? |
|
Oxygen |
? |
? |
? |
? |
|
Nitrogen |
? |
? |
? |
? |
1. So sánh số electron trên từng lớp electron tương ứng trong các nguyên tử trên.
2. Số electron ở lớp electron ngoài cùng của vỏ mỗi nguyên tử trên đã được điền tối đa chưa? Cần thêm bao nhiêu electron để lớp electron để lớp electron ngoài cùng của mỗi nguyên tử trên có số electron tối đa?
 Xem đáp án
Xem đáp án
|
Nguyên tử |
Số proton trong hạt nhân |
Số electron trong vỏ nguyên tử |
Số lớp electron |
Số electron ở lớp electron ngoài cùng |
|
Carbon |
6 |
6 |
2 |
4 |
|
Oxygen |
8 |
8 |
2 |
6 |
|
Nitrogen |
7 |
7 |
2 |
5 |
1. Lớp electron trong cùng của các nguyên tử đều có 2 electron.
Số electron lớp ngoài cùng của carbon, nitrogen và oxygen lần lượt là 4, 5, 6.
2. Số electron ở lớp ngoài cùng của vỏ mỗi nguyên tử chưa được điền tối đa (tối đa là 8 elctron). Để lớp electron ngoài cùng của mỗi nguyên tử có số electron tối đa thì:
+ carbon cần thêm 4 electron.
+ nitrogen cần thêm 3 electron.
+ oxygen cần thêm 2 electron.
Câu 8:
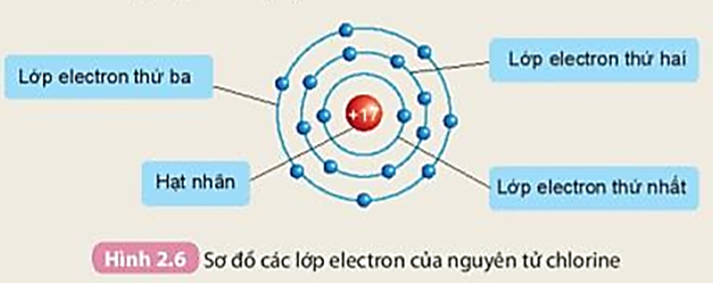
Quan sát Hình 2.6 và cho biết:
1. Thứ tự sắp xếp các electron ở vỏ nguyên tử chlorine.
2. Số electron trên từng lớp ở vỏ nguyên tử chlorine.
 Xem đáp án
Xem đáp án
1. Các electron sắp xếp thành từng lớp. Lớp electron thứ nhất ở trong cùng, gần hạt nhân nhất; lớp electron thứ 2 ở bên ngoài lớp thứ nhất; lớp electron thứ 3 ở ngoài cùng. Các electron sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết.
2. Lớp thứ nhất có 2 electron, lớp thứ 2 có 8 electron, lớp thứ 3 có 7 electron.
Câu 9:
Em hãy cho biết vì sao khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử.
 Xem đáp án
Xem đáp án
Một proton có khối lượng gần đúng bằng khối lượng của một neutron và xấp xỉ bằng 1 amu.
Một electron có khối lượng xấp xỉ bằng 0,00055 amu nhỏ hơn rất nhiều so với khối lượng của proton và neutron.
⇒ Coi khối lượng hạt nhân nguyên tử là khối lượng của nguyên tử.
Câu 10:
Hãy so sánh khối lượng của nguyên tử nhôm (13p, 14n) và nguyên tử đồng (29p, 36n).
 Xem đáp án
Xem đáp án
Ta có thể coi khối lượng hạt nhân nguyên tử là khối lượng của nguyên tử.
Khối lượng của nguyên tử nhôm là 13.1amu + 14.1 amu = 27 amu
Khối lượng của nguyên tử đồng là 29.1 amu + 36.1 amu = 64 amu
⇒ Khối lượng của nguyên tử nhôm nhỏ hơn khối lượng của nguyên tử đồng.
Câu 11:
Làm được mô hình một số nguyên tử theo mô hình nguyên tử của Bo.
 Xem đáp án
Xem đáp án
Làm mô hình nguyên tử hydrogen, oxygen theo mô hình nguyên tử của Bo.
Chuẩn bị: 2 tấm bìa carton, giấy màu vàng, các viên bị nhựa to màu đỏ (2 viên) và các viên bi nhỏ màu xanh (9 viên).
Tiến hành:
- Gắn hai viên bi đỏ vào giữa hai tấm bìa carton làm hạt nhân nguyên tử.
- Cắt giấy màu vàng thành 2 đường tròn có độ dày 1 cm, bán kính 3 cm và 1 đường tròn có độ dày 1cm, bán kính 4 cm.
- Dán giấy vàng vào tấm bìa carton, tấm 1 dán 1 vòng nhỏ; tấm 2 dán 1 vòng nhỏ + 1 vòng lớn sao cho tâm của đường tròn là viên bi đỏ.
- Gắn các viên bi xanh lên đường tròn màu vàng như hình bên dưới.