Giải Hóa 10 Cánh diều Bài 10: Liên kết ion
Hamchoi.vn trân trọng giới thiệu: lời giải bài tập Hóa lớp 10 Bài 10: Liên kết ion sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa 10 Bài 10. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 10: Liên kết ion
Video giải bài tập Hóa lớp 10 Bài 10: Liên kết ion
Mở đầu trang 53 Hóa học 10: Phát biểu nào dưới đây phù hợp với sơ đồ phản ứng ở Hình 10.1?
(1) Nguyên tử Na nhường, nguyên tử Cl nhận electron để trở thành các ion.
(2) Nguyên tử Na và Cl góp chung electron để trở thành các ion.
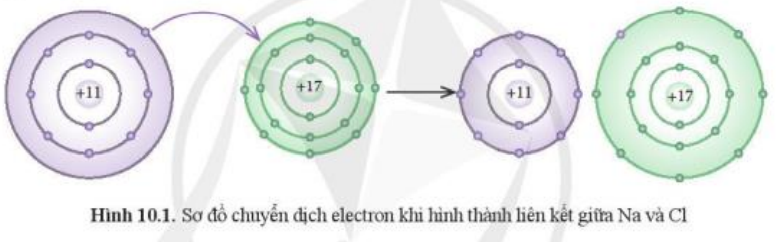
Trả lời:
Phát biểu đúng:
(1) Nguyên tử Na nhường, nguyên tử Cl nhận electron để trở thành các ion.
Cụ thể theo sơ đồ ta thấy:
+ Nguyên tử Na (Z = 11) nhường đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Na+.
+ Nguyên tử Cl (Z = 17) nhận 1 electron từ nguyên tử Na trở thành ion mang điện tích âm, kí hiệu là Cl-.
Các ion Na+ và Cl- hút nhau tạo thành liên kết trong phân tử NaCl.
I. Khái niệm và sự hình thành liên kết ion
1. Khái niệm
Câu hỏi 1 trang 53 Hóa học 10: Phát biểu nào sau đây là đúng?
a) Liên kết ion chỉ có trong đơn chất.
b) Liên kết ion chỉ có trong hợp chất.
c) Liên kết ion có trong cả đơn chất và hợp chất.
Trả lời:
Phát biểu đúng là b) Liên kết ion chỉ có trong hợp chất.
Vì liên kết ion được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. Chỉ trong hợp chất mới có các ion mang điện tích trái dấu.
Luyện tập 1 trang 54 Hóa học 10: Hãy nêu một số hợp chất ion:
a) Tạo nên bởi các ion đơn nguyên tử.
b) Tạo nên bởi ion đơn nguyên tử và ion đa nguyên tử.
c) Tạo nên bởi các ion đa nguyên tử.
Trả lời:
a) Hợp chất ion tạo nên bởi ion đơn nguyên tử: KCl, NaF, BaO ….
K+ + Cl- → KCl
Na+ + F- → NaF
Ba2+ + O2- → BaO
b) Hợp chất ion tạo nên bởi ion đơn nguyên tử và ion đa nguyên tử: KNO3; CaSO4; NH4Cl …
K+ + NO3- → KNO3
Ca2+ + SO42- → CaSO4
NH4+ + Cl- → NH4Cl
c) Hợp chất ion tạo nên bởi các ion đa nguyên tử: (NH4)2SO4; NH4NO3 …
2NH4+ + SO42- → (NH4)2SO4
NH4+ + NO3- → NH4NO3
2. Sự hình thành liên kết ion từ phản ứng giữa các nguyên tử
Câu hỏi 2 trang 54 Hóa học 10: Viết hai giai đoạn của sự hình thành CaO từ các nguyên tử tương ứng (kèm theo cấu hình electron).
Trả lời:
Giai đoạn 1: Hình thành các ion trái dấu từ các quá trình Ca nhường electron và O nhận electron.
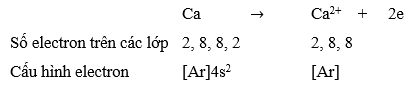
![]()
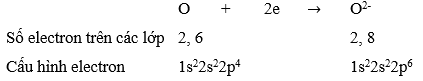
Giai đoạn 2: Hai ion trái dấu Ca2+ và O2- hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion.
Ca2+ + O2- → CaO
Luyện tập 2 trang 54 Hóa học 10: Cho các ion: Li+, Ca2+, Al3+, F-, O2-, PO43-. Hãy viết công thức tất cả các hợp chất ion (tạo nên từ một loại cation và một loại anion) có thể được tạo thành từ các ion đã cho. Biết rằng tổng điện tích của các ion trong hợp chất bằng 0.
Trả lời:
Công thức các hợp chất ion có thể tạo thành là: LiF, Li2O, Li3PO4, CaF2, CaO, Ca3(PO4)2, AlF3, Al2O3, AlPO4.
Li+ + F- → LiF
2Li+ + O2- → Li2O
3Li+ + PO43- → Li3PO4
Ca2+ + 2F- → CaF2
Ca2+ + O2- → CaO
3Ca2+ + 2PO43- → Ca3(PO4)2
Al3+ + 3F- → AlF3
2Al3+ + 3O2- → Al2O3
Al3+ + PO43- → AlPO4
Luyện tập 3 trang 54 Hóa học 10: Cho các chất sau: SiO2 là thành phần chính của thạch anh, CaCO3 là thành phần của đá vôi. Hãy cho biết chất nào được tạo nên bởi liên kết ion? Giải thích.
Trả lời:
- CaCO3 được tạo nên bởi liên kết ion. Giải thích:
Ca2+ + CO32- → CaCO3
- SiO2 được tạo nên từ hai nguyên tố phi kim, liên kết trong phân tử SiO2 là liên kết cộng hóa trị.
II. Tinh thể ion
1. Khái niệm
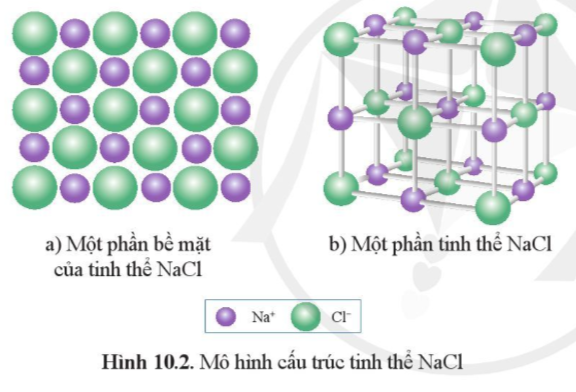
Thực hành 1 trang 55 Hóa học 10: Lắp ráp mô hình tinh thể NaCl: Quan sát hình 10.2 để lắp ráp mô hình tinh thể NaCl từ các quả cầu minh họa cho ion Na+, Cl- và que nối.
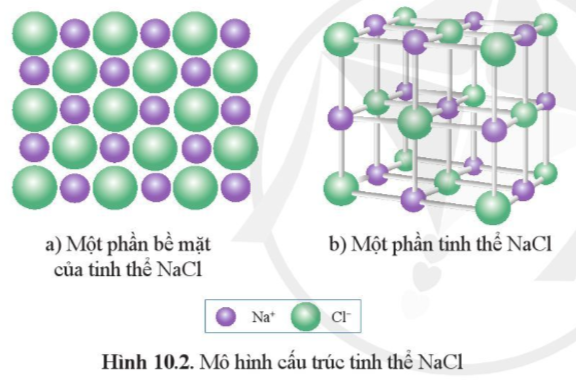
Trả lời:
Học sinh lắp ráp mô hình tinh thể NaCl từ các quả cầu (hoặc đất nặn) minh họa cho ion Na+, Cl- và que nối.

Sản phẩm minh họa
Thực hành 2 trang 55 Hóa học 10: Từ mô hình NaCl, hãy cho biết xung quanh mỗi ion Na+ có bao nhiêu ion Cl- (ở gần nhất với Na+)?
Trả lời:
Từ mô hình tinh thể NaCl xác định được, xung quanh mỗi ion Na+ có 6 ion Cl- (ở gần nhất với Na+).
2. Đặc điểm của hợp chất ion
Vận dụng 1 trang 55 Hóa học 10: Hãy kể tên một số hợp chất ion có xung quanh em và cho biết trong điều kiện thường, chúng tồn tại ở thể nào.
Trả lời:
Một số hợp chất ion có xung quanh em: NaCl (muối ăn); CaO (vôi sống); CaCO3 (đá vôi) …
Trong điều kiện thường các hợp chất trên đều tồn tại ở thể rắn.
Bài tập (trang 56)
Bài 1 trang 56 Hóa học 10: Những phát biểu nào sau đây là đúng?
Hợp chất tạo nên bởi ion Al3+ và O2- là hợp chất
(a) cộng hóa trị. (b) ion.
(c) có công thức Al2O3 (d) có công thức Al3O2
Trả lời:
Đáp án đúng là:
(b) ion;
(c) có công thức Al2O3.
Hai ion Al3+ và O2- trái dấu hút nhau bằng lực hút tĩnh điện tạo hợp chất Al2O3
2Al3+ + 3O2- → Al2O3
⇒ Hợp chất tạo nên bởi ion Al3+ và O2- là hợp chất ion.
Bài 2 trang 56 Hóa học 10: Những tính chất nào sau đây là tính chất điển hình của hợp chất ion?
(a) Tồn tại ở thể khí trong điều kiện thường.
(b) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(c) Thường tồn tại ở thể rắn trong điều kiện thường.
(d) Có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Trả lời:
Những tính chất là tính chất điển hình của hợp chất ion:
(b) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(c) Thường tồn tại ở thể rắn trong điều kiện thường.
Bài 3* trang 56 Hóa học 10:
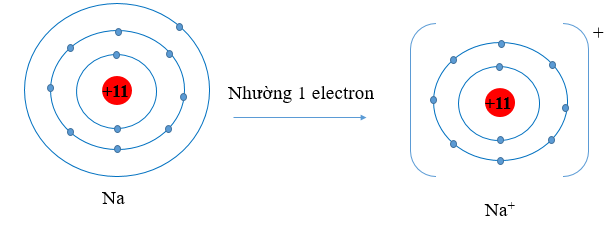
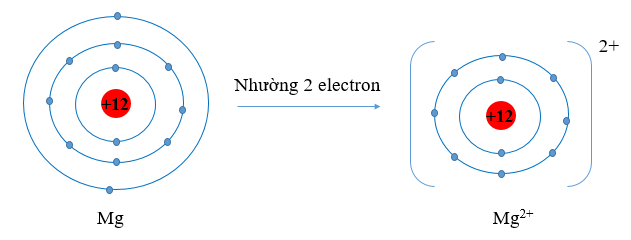
a) Giải thích vì sao bán kính nguyên tử Na, Mg lớn hơn bán kính của các ion kim loại tương ứng.
b) Vì sao cả Na2O và MgO đều là chất rắn ở điều kiện thường?
c) Vì sao nhiệt độ nóng chảy của MgO (2 852oC) cao hơn rất nhiều so với Na2O (1 132oC)?
Trả lời:
a) Nguyên tử kim loại có 1, 2, 3 electron lớp ngoài cùng, có xu hướng nhường 1, 2, 3 electron này để đạt cấu hình bền vững giống như khí hiếm. Khi nhường electron các ion kim loại mất đi một lớp electron ngoài cùng. Do đó bán kính ion kim loại nhỏ hơn bán kính nguyên tử kim loại tương ứng.
⇒ Xét cụ thể với Na và Mg ta có bán kính nguyên tử Na, Mg lớn hơn bán kính của các ion kim loại tương ứng.
b) Na2O; MgO là các hợp chất ion do đó chúng đều là chất rắn ở nhiệt độ thường.
c) Lực hút tĩnh điện được tính theo công thức sau:
(q1, q2) là giá trị điện tích của hai điện tích điểm, đơn vị là C (coulomb);
r là khoảng cách giữa hai điện tích điểm; đơn vị là m (meter);
k là hằng số coulomb).
Xét hai phân tử Na2O và MgO ta có:
+ Bán kính ion Na+ > bán kính ion Mg2+
+ Điện tích ion Mg2+ > điện tích ion Na+
⇒ hay liên kết trong MgO bền hơn nhiều so với trong Na2O. Điều này dẫn đến nhiệt độ nóng chảy của MgO cao hơn nhiều so với Na2O.
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 11: Liên kết cộng hóa trị
Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Bài 13: Phản ứng oxi hóa – khử
Bài 14: Phản ứng hóa học và enthalpy
Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
Xem thêm tài liệu Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài viết liên quan
- Giải Hóa 10 Cánh diều Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Giải Hóa 10 Cánh diều Bài 9: Quy tắc octet
- Giải Hóa 10 Cánh diều Bài 11: Liên kết cộng hóa trị
- Giải Hóa 10 Cánh diều Bài 12: Liên kết hydrogen và tương tác Van Der Waals
- Giải Hóa 10 Cánh diều Bài 13: Phản ứng oxi hóa – khử
