Giải Hóa 10 Cánh diều Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Hamchoi.vn trân trọng giới thiệu: lời giải bài tập Hóa lớp 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa 10 Bài 12. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Video giải bài tập Hóa lớp 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Mở đầu trang 64 Hóa học 10: Hai phân tử nước có thể liên kết được với nhau. Dựa vào sự phân bố điện tích trong phân tử nước (Hình 12.1), cho biết liên kết giữa hai phân tử nước có thể được hình thành qua cặp nguyên tử nào?
(1) O với O
(2) H với H
(3) O với H
Giải thích sự lựa chọn của em.
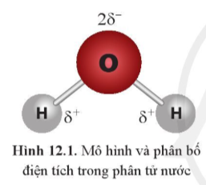
Trả lời:
Chọn (3) O với H
Giải thích:
Nguyên tử O của phân tử nước này (mang một phần điện tích âm) và nguyên tử H của phân tử nước kia (mang một phần điện tích dương) sẽ hút nhau bằng lực hút tĩnh điện.
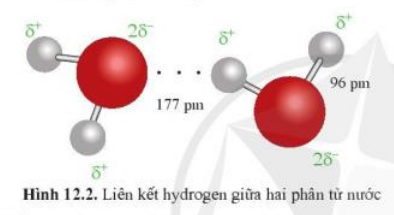
Vậy liên kết giữa hai phân tử nước có thể được hình thành qua cặp nguyên tử O với H do lực hút tĩnh điện giữa hai nguyên tử.
I. Liên kết hydrogen
1. Khái niệm
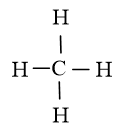
Câu hỏi 1 trang 65 Hóa học 10: Vì sao nguyên tử H của phân tử H2O không tạo được liên kết hydrogen với nguyên tử C của phân tử CH4?
Trả lời:
Vì nguyên tử C của phân tử CH4 không còn cặp electron riêng
Công thức Lewis của CH4:
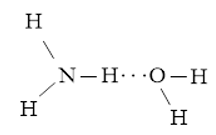
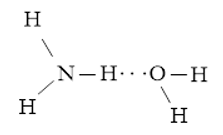
Luyện tập 1 trang 65 Hóa học 10: Viết các khả năng tạo thành liên kết hydrogen giữa một phân tử H2O và một phân tử NH3.
Trả lời:
Các khả năng tạo thành liên kết hydrogen giữa một phân tử H2O và một phân tử NH3:
+ Nguyên tử H trong phân tử H2O tạo liên kết hydrogen với nguyên tử N trong phân tử NH3
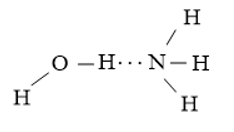
+ Nguyên tử H trong phân tử NH3 tạo liên kết hydrogen với nguyên tử O trong phân tử H2O.
Vận dụng 1 trang 65 Hóa học 10: Vì sao HF có tính acid yếu hơn rất nhiều so với HCl? Biết rằng tính acid của một chất càng mạnh nếu phân tử đó càng dễ phân li thành ion H+.
Trả lời:
Độ âm điện của F lớn hơn Cl nên tương tác hút tĩnh điện giữa Hδ+ và Fδ- lớn hơn tương tác hút tĩnh điện giữa Hδ+ và Clδ-
⇒ Hδ+ trong phân tử HCl dễ phân li ra ion H+ hơn
⇒ Tính acid của HCl mạnh hơn tính acid của HF
Ngoài ra, ở nhiệt độ thấp, hydrogen fluoride (HF) tồn tại ở thể rắn dưới dạng polymer (HF)n nhờ liên kết hydrogen:
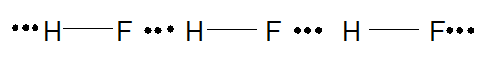
2. Ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
a) Đặc điểm tập hợp
b) Nhiệt độ nóng chảy và nhiệt độ sôi
Luyện tập 2 trang 66 Hóa học 10: Vẽ các liên kết hydrogen được hình thành giữa H2O với mỗi phân tử NH3, C2H5OH.
Trả lời:
- Liên kết hydrogen được hình thành giữa H2O và NH3
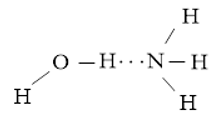
Hoặc
- Liên kết hydrogen được hình thành giữa H2O và C2H5OH
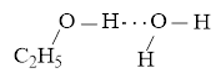
Hoặc
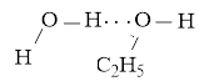
Vận dụng 2 trang 66 Hóa học 10: Hãy giải thích vì sao trong quá trình chưng cất rượu, C2H5OH bay trước H2O mặc dù khối lượng phân tử C2H5OH lớn hơn rất nhiều khối lượng phân tử H2O
Trả lời:
Liên kết O-H trong phân tử nước phân cực hơn so với liên kết O-H trong phân tử rượu.
Liên kết hydrogen giữa các phân tử nước với nhau bền vững hơn rất nhiều liên kết hydrogen giữa các phân tử rượu với nhau dẫn đến nhiệt độ sôi của nước (100oC) lớn hơn nhiệt độ sôi của rượu (78,3oC) mặc dù khối lượng phân tử C2H5OH lớn hơn rất nhiều khối lượng phân tử H2O.
II. Tương tác van der Waals
1. Khái niệm
Vận dụng 3 trang 67 Hóa học 10: Giải thích vì sao con tắc kè có thể di chuyển trên mặt kính trơn nhẵn, thẳng đứng.

Trả lời:
Con tắc kè có thể di chuyển trên mặt kính trơn nhẵn, thẳng đứng vì có sự bám hút (tương tác van der Waals) giữa bàn chân con tắc kè và mặt kính.
2. Ảnh hưởng của tương tác van der Waals tới tính chất vật lí của các chất.
Vận dụng 4 trang 68 Hóa học 10: Sưu tầm hình ảnh tinh thể nước đá, bông tuyết.
Trả lời:
Một số hình ảnh tinh thể nước đá, bông tuyết:

Vận dụng 5 trang 68 Hóa học 10: Thu thập thông tin liên quan đến các hiện tượng có xuất hiện của liên kết hydrogen, tương tác van der Waals trong thực tiễn.
Trả lời:
- Liên kết hydrogen giữa các phân tử nước trên bề mặt nước và giữa các phân tử nước trên bề mặt và lớp nước bên dưới tạo ra sức căng bề mặt cho nước. Chân của con nhện nước gồm các chất kị nước, phân tử các chất này đẩy nước khiến cho chân của nhện nước không bị nước bao bọc và tụt xuống dưới nước. Vì vậy chúng có thể di chuyển trên bề mặt nước mà không làm vỡ bề mặt nước.

- Bong bóng xà phòng thể hiện tương tác giữa các phân tử nước và các phân tử xà phòng tạo thành màng mỏng, giữ được không khí bên trong bay lên.

Bài tập (trang 69)
Bài 1 trang 69 Hóa học 10: Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây?
A. CH4
B. NH3
C. H3C-O-CH3
D. PH3
Trả lời:
Đáp án đúng là: B
A. Loại vì trong phân tử CH4 nguyên tử C không có cặp electron riêng.
Công thức Lewis của CH4
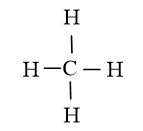
B. Chọn
C. Loại vì trong phân tử H3C-O-CH3 nguyên tử C và O đều không có cặp electron riêng.
D. Loại vì độ âm điện của P nhỏ hơn của H
Bài 2 trang 69 Hóa học 10: Nhiệt nóng chảy và nhiệt độ sôi của hai chất HBr và HF như sau:
|
Chất |
Nhiệt độ nóng chảy (oC) |
Nhiệt độ sôi (oC) |
|
? |
-86,9 |
-66,8 |
|
? |
-83,6 |
19,5 |
Hãy gán công thức chất thích hợp vào các ô có dấu?.
Trả lời:
|
Chất |
Nhiệt độ nóng chảy (oC) |
Nhiệt độ sôi (oC) |
|
HBr |
-86,9 |
-66,8 |
|
HF |
-83,6 |
19,5 |
Độ âm điện của F lớn hơn Br nên tương tác hút tĩnh điện giữa Hδ+ và Fδ- lớn hơn tương tác hút tĩnh điện giữa Hδ+ và Brδ-
⇒ Các phân tử HF liên kết chặt chẽ với nhau bởi các liên kết hydrogen hơn so với các phân tử HBr.
⇒ Nhiệt độ nóng chảy và nhiệt độ sôi của HF lớn hơn so với HBr.
Chú ý: Ở nhiệt độ thấp, hydrogen fluoride (HF) tồn tại ở thể rắn dưới dạng polymer (HF)n nhờ liên kết hydrogen:
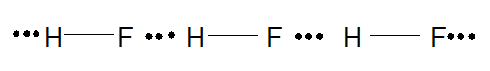
Bài 3 trang 69 Hóa học 10: Những phát biểu nào sau đây đúng khi nói về các loại liên kết?
a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hóa trị.
c) Tương tác van der Waals yếu hơn liên kết hydrogen.
d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
Trả lời:
Phát biểu đúng là: a), c)
a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
c) Tương tác van der Waals yếu hơn liên kết hydrogen.
Bài 4 trang 69 Hóa học 10: Các liên kết biểu diễn bằng các đường nét đứt được minh họa như hình dưới đây có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA. Đó là loại liên kết gì?
A. Liên kết ion
B. Liên kết cộng hóa trị có cực
C. Liên kết cộng hóa trị không cực
D. Liên kết hydrogen.
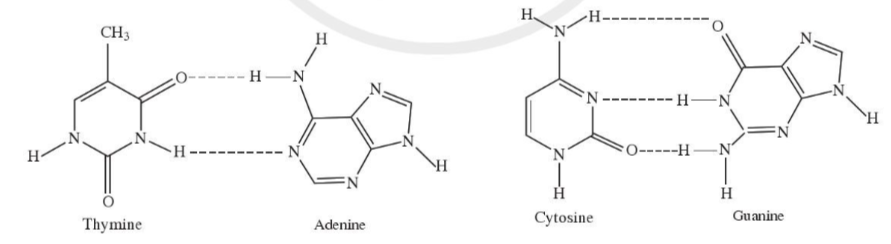
Trả lời
Đáp án đúng là: D
Liên kết biểu diễn bằng các đường nét đứt là liên kết hydrogen.
Bài 5 trang 69 Hóa học 10: Một kết quả nghiên cứu mới đây cho thấy các phân tử NH3 có thể liên kết với nhau thành những cụm (NH3)n với n = 3 – 6. (Theo ACS Omega 2020, 5, 49, 31724-31729)
Vì sao các phân tử NH3 có thể hình thành được cụm phân tử này?
Trả lời:
Trong phân tử NH3 có nguyên tử H liên kết với nguyên tử N (có độ âm điện mạnh) còn cặp electron riêng.
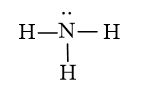
Do đó các phân tử NH3 có thể liên kết với nhau bằng liên kết hydrogen tạo thành những cụm phân tử.
Cụm phân tử (NH3)3
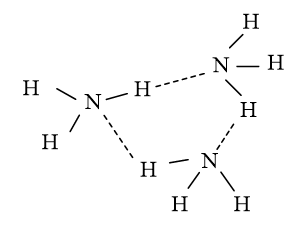
Cụm phân tử (NH3)4
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
