Cho 2 kí hiệu nguyên tử sau: .
Biểu diễn cấu hình electron của A, B theo ô orbital, từ đó cho biết số electron độc thân của mỗi nguyên tử.
 Giải bởi Vietjack
Giải bởi Vietjack
+ Dựa vào kí hiệu nguyên tử có ZA = 9.
Cấu hình electron nguyên tử A: 1s22s22p5.
Biểu diễn cấu hình electron nguyên tử A theo ô orbital:
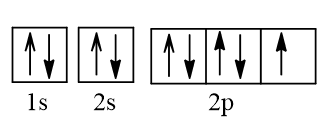
Vậy ở trạng thái cơ bản, A có 1 electron độc thân.
+ Dựa vào kí hiệu nguyên tử có ZB = 14.
Cấu hình electron nguyên tử B: 1s22s22p63s23p2.
Biểu diễn cấu hình electron nguyên tử B theo ô orbital:
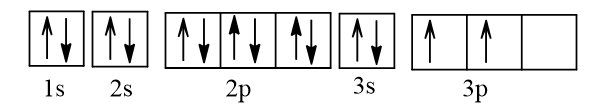
Vậy ở trạng thái cơ bản, B có 2 electron độc thân.
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Trong tự nhiên nguyên tố copper (kí hiệu: Cu) có 2 đồng vị là và , trong đó đồng vị chiếm 27% về số nguyên tử. Tính phần trăm khối lượng của trong phân tử Cu2O (biết rằng nguyên tử khối trung bình của O bằng 16).
Khối lượng của nguyên tử magnesium là 39,8271.10-27 kg. Khối lượng của magnesium theo amu là
Nguyên tử nguyên tố X có tổng số hạt electron trong các phân lớp s là 5. Số electron của X ít hơn số electron của Y là 4 hạt.
Xác định vị trí X, Y trong bảng tuần hoàn có giải thích ngắn gọn.
Nguyên tử của nguyên tố M có cấu hình electron là 1s22s22p4. Số electron độc thân của M ở trạng thái cơ bản là
Phát biểu nào đúng khi nói về các orbital trong một phân lớp electron?
Nguyên tử sulfur có phân lớp electron ngoài cùng là 3p4. Phát biểu nào sau đây là sai khi nói về nguyên tử sulfur?
Số proton và số neutron có trong một nguyên tử aluminium () lần lượt là
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có
Nguyên tố R có hai đồng vị, nguyên tử khối trung bình là 79,91. Một trong hai đồng vị là (chiếm 54,5%). Nguyên tử khối của đồng vị thứ hai là