Giải Hoá học 10 Chân trời sáng tạo Bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Hamchoi.vn trân trọng giới thiệu: lời giải bài tập Hoá học lớp 10 Bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá học 10 Bài 7. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Video giải Hóa lớp 10 Bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Mở đầu trang 49 Hóa học 10: Fluorine được sử dụng làm chất oxi hóa cho nhiên liệu lỏng dùng trong tên lửa. Fluorine (F) là một nguyên tố hóa học có số hiệu nguyên tử bằng 9, thuộc chu kì 2, nhóm VIIA. Từ vị trí của fluorine trong bảng tuần hoàn, có thể dự đoán được tính chất hóa học cơ bản của fluorine không? Khả năng phản ứng của fluorine như thế nào?

Lời giải:
Từ vị trí của fluorine trong bảng tuần hoàn dự đoán:
+ Fluorine là phi kim mạnh;
+ Fluorine có 7 electron lớp ngoài cùng, dễ nhận 1 electron tạo thành ion F-, vậy fluorine dễ dàng tham gia các phản ứng hóa học.
1. Định luật tuần hoàn
Câu hỏi 1 trang 49 Hóa học 10: Quan sát Bảng 7.1 hãy nhận xét về số electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A trong cùng một chu kì và trong cùng một nhóm?
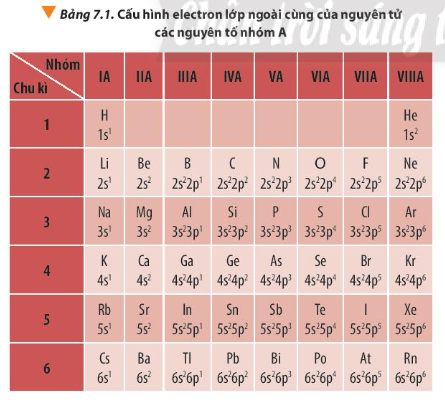
Lời giải:
Với các nguyên tố nhóm A trong bảng tuần hoàn:
- Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, số electron lớp ngoài cùng tăng dần từ 1 đến 8 (trừ chu kì 1).
- Trong một nhóm, các nguyên tử có số electron lớp ngoài cùng bằng nhau (trừ nhóm VIIIA - He).
Luyện tập trang 50 Hóa học 10: Hãy nêu xu hướng biến đổi một số tính chất của các nguyên tố, đơn chất và hợp chất của chúng để minh họa nội dung của định luật tuần hoàn.
Lời giải:
Xu hướng biến đổi một số tính chất của các nguyên tố, đơn chất và hợp chất:
+ Trong một chu kì, theo chiều tăng của điện tích hạt nhân bán kính nguyên tử có xu hướng giảm dần, độ âm điện của nguyên tử các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng của điện tích hạt nhân bán kính nguyên tử có xu hướng tăng dần, độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần.
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
+ Tính aid – base của oxide và hydroxide: Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, tính acid của chúng tăng dần.
Định luật tuần hoàn: Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó, biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
2. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Câu hỏi 2 trang 50 Hóa học 10: Dựa trên các kiến thức đã được học, hoàn thành những thông tin còn thiếu trong Bảng 7.2

Lời giải:
|
Cấu tạo nguyên tử Ca: Cấu hình electron: 1s22s22p63s23p64s2 Số proton, số electron: 20 Số lớp electron: 4 Số electron lớp ngoài cùng: 2 |
|
Ví trí nguyên tố Ca Số thứ tự nguyên tố: 20 Số thứ tự chu kì: 4 Nhóm: IIA
|
|
Tính chất nguyên tố Ca - Tính kim loại, tính phi kim: kim loại mạnh - Hóa trị cao nhất với oxygen: 2 - Công thức oxide cao nhất: CaO - Công thức hydroxide tương ứng: Ca(OH)2 - Tính acid, base của oxide cao nhất và hydroxide: base mạnh |
||
Luyện tập trang 50 Hóa học 10: a) Nguyên tố potassium thuộc ô 19 trong bảng tuần hoàn. Cho biết cấu tạo của nguyên tử này.
b) Nguyên tử của nguyên tố chlorine có 17 proton. Cho biết vị trí của nguyên tố này trong bảng tuần hoàn.
c) Nguyên tử của nguyên tố sulfur thuộc ô 16 trong bảng tuần hoàn. Cho biết tính chất hóa học cơ bản của nguyên tố sulfur.
Lời giải:
a) Nguyên tố potassium thuộc ô 19.
Số hiệu nguyên tử (Z) = 19 = số proton = số electron.
Cấu hình electron K (Z = 19): 1s22s22p63s23p64s1.
Số lớp electron: 4.
Số electron lớp ngoài cùng: 1.
b) Nguyên tử của nguyên tố chlorine có 17 proton.
Số hiệu nguyên tử (Z) = số proton = số electron = 17.
Cấu hình electron: 1s22s22p63s23p5.
Vậy chlorine thuộc:
+ Ô thứ 17 (do Z = 17)
+ Chu kì 3 (do có 3 lớp electron)
+ Nhóm VIIA (do 7 electron hóa trị, nguyên tố p).
c) Nguyên tử của nguyên tố sulfur thuộc ô 16
Số hiệu nguyên tử (Z) = số proton = số electron = 16.
Cấu hình electron: 1s22s22p63s23p4.
Sulfur là phi kim do có 6 electron lớp ngoài cùng.
Hóa trị cao nhất với oxygen là VI.
Công thức oxide cao nhất: SO3 là acidic oxide.
Công thức hydroxide tương ứng: H2SO4 là acid mạnh.
Vận dụng trang 51 Hóa học 10: Potassium hydroxide (KOH) là một trong những hóa chất quan trọng của ngành công nghiệp. Chất này được sử dụng để sản xuất chất tẩy rửa gia dụng, thuốc nhuộm vải, phân bón, … Hãy dự đoán hydroxide này có tính base mạnh hay yếu

Lời giải:
K thuộc nhóm IA trong bảng tuần hoàn, có thể dự đoán KOH có tính base mạnh
Bài tập (trang 51)
Bài 1 trang 51 Hóa học 10: Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần
A. khối lượng nguyên tử
B. bán kính nguyên tử
C. số hiệu nguyên tử
D. độ âm điện của nguyên tử
Lời giải:
Đáp án đúng là C
Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần số hiệu nguyên tử.
Bài 2 trang 51 Hóa học 10: Nguyên tố Ca có số hiệu nguyên tử là 20. Phát biểu nào sau đây về Ca là không đúng?
A. Số electron ở vỏ nguyên tử của nguyên tố Ca là 20
B. Vỏ của nguyên tử Ca có 4 lớp electron và lớp ngoài cùng có 2 electron
C. Hạt nhân của nguyên tố Ca có 20 proton
D. Nguyên tố Ca là một phi kim
Lời giải:
Đáp án đúng là: D
Nguyên tố Ca có số hiệu nguyên tử là 20
⇒ Số hiệu nguyên tử (Z) = số proton = số electron = 20 (vậy A và C đúng)
Cấu hình electron: 1s22s22p63s23p64s2
⇒ Vỏ của nguyên tử Ca có 4 lớp electron và lớp ngoài cùng có 2 electron (vậy B đúng).
⇒ Nguyên tố Ca là một kim loại (vậy D sai).
Bài 3 trang 51 Hóa học 10: Một nguyên tố kim loại được sử dụng làm vỏ lon nước giải khát. Nguyên tử của các nguyên tố này có cấu hình electron: [Ne]3s23p1. Hãy xác định tên nguyên tố này và vị trí của nó trong bảng tuần hoàn. Nêu cấu tạo nguyên tử và tính chất của nguyên tố này.
Lời giải:
Nguyên tố cần tìm là Al (nhôm hay aluminium) nằm ở ô số 13, chu kì 3, nhóm IIIA trong bảng tuần hoàn.
Cấu tạo nguyên tử:
Cấu hình electron: 1s22s22p63s23p1
Số proton, số electron: 13
Số lớp electron: 3
Số electron lớp ngoài cùng: 3
Tính chất nguyên tố Al:
Tính kim loại, tính phi kim: là kim loại có tính khử mạnh
Hóa trị cao nhất với oxygen: 3
Công thức oxide cao nhất: Al2O3
Công thức hydroxide tương ứng: Al(OH)3
Tính acid, base của oxide cao nhất và hydroxide: là oxide và hydroxide lưỡng tính.
Bài 4 trang 51 Hóa học 10: Nguyên tử của một nguyên tố có cấu hình electron: [Ar] 4s2. Nguyên tố này là một trong những nguyên tố thiết yếu cho cơ thể, được bổ sung trong các sản phẩm sữa. Hãy xác định vị trí nguyên tố này trong bảng tuần hoàn và cho biết tính chất của nó.
Lời giải:
Nguyên tố cần tìm là Ca
Ví trí nguyên tố Ca:
Số thứ tự nguyên tố: 20
Số thứ tự chu kì: 4
Nhóm: IIA
Tính chất nguyên tố Ca
Tính kim loại, tính phi kim: kim loại mạnh
Hóa trị cao nhất với oxygen: 2
Công thức oxide cao nhất: CaO
Công thức hydroxide tương ứng: Ca(OH)2.
Tính acid, base của oxide cao nhất và hydroxide: base mạnh.
Bài viết liên quan
- Giải Hoá học 10 Chân trời sáng tạo Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
- Giải Hoá học 10 Chân trời sáng tạo Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm
- Giải Hoá học 10 Chân trời sáng tạo Bài 8: Quy tắc octet
- Giải Hoá học 10 Chân trời sáng tạo Bài 9: Liên kết ion
- Giải Hoá học 10 Chân trời sáng tạo Bài 10: Liên kết cộng hóa trị

