Giải Hoá học 10 Chân trời sáng tạo Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Hamchoi.vn trân trọng giới thiệu: lời giải bài tập Hoá học lớp 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá học 10 Bài 12. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Mở đầu trang 72 Hóa học 10: Đom đóm có thể phát ra ánh sáng đặc biệt, không tỏa nhiệt như ánh sáng nhân tạo. Cấu tạo bên trong lớp da bụng của đom đóm là dãy các tế bào phát quang có chứa luciferin. Luciferin tác dụng với oxygen, cùng xúc tác enzyme, để tạo ra ánh sáng. Đây là phản ứng oxi hóa – khử.
Trong cuộc sống cũng như trong tự nhiên có nhiều hiện tượng mà nguyên nhân chính là do phản ứng oxi hóa – khử gây ra. Phản ứng oxi hóa – khử là gì? Vai trò quan trọng của chúng trong cuộc sống như thế nào?

Lời giải:
- Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
- Vai trò của phản ứng oxi hóa khử trong cuộc sống:
+ Một số phản ứng oxi hóa – khử quan trọng gắn liền với cuộc sống như sự cháy của than, củi; sự cháy của xăng, dầu trong các động cơ đốt trong; các quá trình điện phân; các phản ứng xảy ra trong pin, ắc quy; …
+ Một số phản ứng oxi hóa – khử là cơ sở của quá trình sản xuất trong các ngành công nghiệp năng; sản xuất các hóa chất cơ bản; sản xuất phân bón; thuốc bảo vệ thực vật; dược phẩm;…
1. Số oxi hóa
Câu hỏi 1 trang 72 Hóa học 10: Quan sát Hình 12.1, hãy viết quá trình nhường và nhận electron trong phản ứng giữa magnesium và oxygen
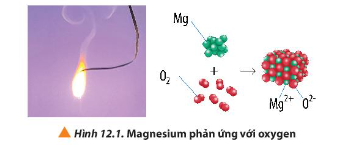
Lời giải:
Quá trình nhường electron: Mg → Mg2+ + 2e
Quá trình nhận electron: O2 + 4e → 2O2-
Câu hỏi 2 trang 73 Hóa học 10: Quan sát Hình 12.2a hydrogen cháy trong chlorine với ngọn lửa sáng, tạo hợp chất hydrogen chloride (HCl). Nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl (Hình 12.2b), hãy xác định điện tích của các nguyên tử trong phân tử HCl

Lời giải:
Nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl khi đó có thể coi Cl nhận 1 electron và H nhường 1 electron ⇒ Cl mang điện tích -1 và H mang điện tích +1.
Câu hỏi 3 trang 73 Hóa học 10: Nêu điểm khác nhau giữa kí hiệu oxi hóa và kí hiệu điện tích của ion M trong hình sau:
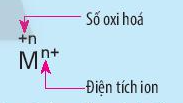
Lời giải:
Kí hiệu số oxi hóa: dấu viết trước, số viết sau.
Kí hiệu điện tích ion: số viết trước, dấu viết sau.
Câu hỏi 4 trang 73 Hóa học 10: Dự đoán số oxi hóa của các nguyên tử trong nhóm IA, IIA, IIIA trong các hợp chất. Giải thích
Lời giải:
Các nguyên tử trong nhóm IA, IIA, IIIA dễ dàng nhường đi 1, 2, 3 electron ở lớp ngoài cùng. Dự đoán, số oxi hóa của các nguyên tử trong nhóm IA, IIA, IIIA trong các hợp chất lần lượt là +1; +2; +3.
Luyện tập trang 73 Hóa học 10: Hãy xác định số oxi hóa của các nguyên tử trong các đơn chất, hợp chất và ion sau: Zn, H2, Cl‑, O2-, S2-, HSO4-, Na2S2O3, KNO3
Lời giải:
- Với các đơn chất:
- Với các ion đơn nguyên tử: Số oxi hóa của nguyên tử Cl, O, S trong Cl‑, O2-, S2- lần lượt bằng -1; -2; -2.
- Với ion đa nguyên tử: HSO4-
+ Số oxi hóa của H là +1, của O là -2
+ Số oxi hóa của S là x ta có: 1.(+1) + 1.x + 4.(-2) = -1 ⇒ x = +6
- Với các phân tử hợp chất:
+ Xét phân tử Na2S2O3:
Số oxi hóa của Na là +1; số oxi hóa của O là -2
Số oxi hóa của S là x ta có: 2.(+1) + 2.x + 3.(-2) = 0 ⇒ x = +2
+ Xét phân tử KNO3:
Số oxi hóa của K là +1; số oxi hóa của O là -2
Số oxi hóa của N là x ta có: 1.(+1) + 1.x + 3.(-2) = 0 ⇒ x = +5
Luyên tập trang 74 Hóa học 10: Magnetite là khoáng vật sắt từ có hàm lượng sắt cao nhất được dùng trong ngành luyện gang, thép, với công thức hóa học là Fe3O4. Hãy xác định số oxi hóa của nguyên tử Fe trong hợp chất trên.

Lời giải:
Gọi số oxi hóa của Fe là x ta có:
3.x + 4. (-2) = 0 ⇒ x =
Vậy số oxi hóa của Fe trong Fe3O4 là .
2. Phản ứng oxi hóa – khử
Câu hỏi 5 trang 75 Hóa học 10: Hãy nhận xét và giải thích sự thay đổi số oxi hóa của các nguyên tử trong chất oxi hóa và chất khử trước và sau phản ứng.
Lời giải:
Chất oxi hóa là chất nhận electron, chất có số oxi hóa giảm sau phản ứng.
Chất khử là chất nhường electron, chất có số oxi hóa tăng sau phản ứng.
Luyện tập trang 75 Hóa học 10: Cho phương trình hóa học của các phản ứng sau:
H2S + Br2 → 2HBr + S↓ (1)
2KClO3 2KCl + 3O2↑ (2)
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O (3)
Phản ứng nào là phản ứng oxi hóa – khử? Vì sao? Hãy xác định quá trình oxi hóa và quá trình khử của các phản ứng đó
Lời giải:
Phản ứng (1) và (2) là phản ứng oxi hóa khử vì có sự thay đổi số oxi hóa của các nguyên tử trước và sau phản ứng.
- Xét phương trình hóa học:
Quá trình oxi hóa:
Quá trình khử:
- Xét phương trình hóa học:
Quá trình oxi hóa:
Quá trình khử:
Câu hỏi 6 trang 76 Hóa học 10: Làm thế nào để biết một phản ứng là phản ứng oxi hóa – khử?
Lời giải:
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đối số oxi hóa của một số nguyên tử trước và sau phản ứng.
Luyện tập trang 76 Hóa học 10: Hãy nêu 3 ví dụ về phản ứng có sự thay đổi số oxi hóa của nguyên tử và 3 ví dụ về phản ứng không có sự thay đổi số oxi hóa của nguyên tử.
Lời giải:
3 ví dụ về phản ứng có sự thay đổi số oxi hóa của nguyên tử:
3 ví dụ về phản ứng không có sự thay đổi số oxi hóa của nguyên tử
3. Lập phương trình hóa học của phản ứng oxi hóa – khử
Luyện tập trang 77 Hóa học 10: Lập phương trình hóa học của các phản ứng oxi hóa - khử sau, xác định vai trò của các chất tham gia phản ứng.
KMnO4 + HCl → KCl + MnCl2 + Cl↑ + H2O (1)
NH3 + Br2 → N2 + HBr (2)
NH3 + CuO Cu + N2 + H2O (3)
FeS2 + O2 Fe2O3 + SO2 (4)
KClO3 KCl + O2↑ (5)
Lời giải:
KMnO4 + HCl → KCl + MnCl2 + Cl↑ + H2O (1)
Bước 1:
Chất khử: HCl
Chất oxi hóa: KMnO4
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
NH3 + Br2 → N2 + HBr (2)
Bước 1:
Chất khử: NH3
Chất oxi hóa: Br2
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
2NH3 + 3Br2 → N2 + 6HBr
NH3 + CuO Cu + N2 + H2O (3)
Bước 1:
Chất khử: NH3
Chất oxi hóa: CuO
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
2NH3 + 3CuO 3Cu + N2 + 3H2O
FeS2 + O2 Fe2O3 + SO2 (4)
Bước 1:
Chất khử: FeS2
Chất oxi hóa: O2
Bước 2: Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
4FeS2 + 11O2 2Fe2O3 + 8SO2
KClO3 KCl + O2↑ (5)
Bước 1:
KClO3 vừa là chất khử, vừa là chất oxi hóa
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4: 2KClO3 2KCl + 3O2↑
4. Ý nghĩa của phản ứng oxi hóa – khử
Câu hỏi 7 trang 77 Hóa học 10: Lập phương trình hóa học của phản ứng đốt cháy gas trong không khí và phản ứng kích nổ hỗn hợp nhiên liệu của tàu con thoi. Xác định vai trò của các chất trong mỗi phản ứng.
Lời giải:
- Gas (thành phần chính là hỗn hợp propane (C3H8) và butane (C4H10) được hóa lỏng).
Phản ứng đốt cháy gas trong không khí:
Trong hai phản ứng trên C3H8 và C4H10 là chất khử, O2 là chất oxi hóa.
- Phản ứng kích nổ hỗn hợp nhiên liệu của tàu con thoi:
Trong phản ứng này, H2 là chất khử, O2 là chất oxi hóa
Câu hỏi 8 trang 78 Hóa học 10: Quan sát Hình 12.7 và đọc thông tin, hãy lập phương trình hóa học của phản ứng quang hợp ở cây xanh. Quá trình quang hợp của thực vật có vai trò quan trọng như thế nào đối với cuộc sống?

Lời giải:
- Phương trình hóa học của phản ứng quang hợp ở cây xanh:
6CO2 + 6H2O C6H12O6 + 6O2
- Vai trò của phản ứng quang hợp:
+ Cung cấp oxygen cho sự sống và sự cháy trên Trái Đất.
+ Điều hòa không khí trên Trái Đất.
+ Tổng hợp chất hữu cơ carbohydrate là nguồn thức ăn cho nhiều sinh vật, là nguyên liệu cho công nghiệp và làm ra thuốc chữa bệnh cho con người.
+ Cung cấp năng lượng cho hoạt động sống của sinh vật.
Câu hỏi 9 trang 78 Hóa học 10: Từ thông tin về “Luyện kim”, viết phản ứng của khí carbon monoxide khử iron(III) oxide ở nhiệt độ cao. Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron, xác định vai trò của các chất trong phản ứng.
Lời giải:
Phản ứng của khí carbon monoxide khử iron(III) oxide ở nhiệt độ cao:
CO + Fe2O3 CO2 + Fe
Bước 1:
Chất khử: CO
Chất oxi hóa: Fe2O3
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4: Fe2O3 + 3CO 2Fe + 3CO2
Câu hỏi 10 trang 78 Hóa học 10: Đọc thông tin về “Điện hóa” để biết được phản ứng oxi hóa – khử gắn liền với cuộc sống. Lập phương trình hóa học của phản ứng sinh ra dòng điện trong pin khi zinc phản ứng với manganese.
Lời giải:
Zn + MnO2 ZnO + Mn2O3
Bước 1:
Chất khử: Zn
Chất oxi hóa: MnO2
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4: Zn + 2MnO2 ZnO + Mn2O3
Vận dụng trang 78 Hóa học 10: Hãy nêu thêm một số phản ứng oxi hóa – khử quan trọng gắn với đời sống hằng ngày
Lời giải:
Một số phản ứng oxi hóa – khử quan trọng gắn với đời sống hằng ngày:
- Phản ứng đốt than để đun nấu:
C + O2 CO2
- Phản ứng đốt cháy gas để đun nấu:
C3H8 + 5O2 3CO2 + 4H2O
2C4H10 + 13O2 8CO2 + 10H2O
- Phản ứng quang hợp ở cây xanh:
6CO2 + 6H2O C6H12O6 + 6O2
Bài tập (trang 79)
Bài 1 trang 79 Hóa học 10: Tính số oxi hóa của nguyên tử có đánh dấu ∗ trong các chất và ion dưới đây:
a)
b)
Lời giải:
a)
- Xét hợp chất K2Cr2O7:
Đặt số oxi hóa của Cr là x ta có: 2.(+1) + 2.x + 7.(-2) = 0 ⇒ x = +6
⇒ Số oxi hóa của Cr trong hợp chất K2Cr2O7 bằng +6.
- Xét hợp chất KMnO4:
Đặt số oxi hóa của Mn là x ta có: 1.(+1) + 1.x + 4.(-2) = 0 ⇒ x = +7
⇒ Số oxi hóa của Mn trong hợp chất KMnO4 bằng +7.
- Xét hợp chất KClO4:
Đặt số oxi hóa của Cl là x ta có: 1.(+1) + 1.x + 4.(-2) = 0 ⇒ x = +7
⇒ Số oxi hóa của Cl trong hợp chất KClO4 bằng +7.
- Xét hợp chất NH4NO3:
Đặt số oxi hóa của N được đánh dấu ∗ là x. Nhóm có điện tích +1 nên ta có:
1.x + 4.(+1) = +1 ⇒ x = -3
Vậy số oxi hóa của nguyên tử N được đánh dấu ∗ là -3
b) - Xét ion :
Đặt số oxi hóa của Al là x ta có:1.x + 2.(-2) = -1 ⇒ x = +3
Vậy số oxi hóa của Al trong ion bằng +3.
- Xét ion :
Đặt số oxi hóa của P là x ta có: 1.x + 4.(-2) = -3 ⇒ x = +5
Vậy số oxi hóa của P trong ion bằng +5.
- Xét ion :
Đặt số oxi hóa của Cl là x ta có: 1.x + 3.(-2) = -1 ⇒ x = +5.
Vậy số oxi hóa của Cl trong ion bằng +5.
- Xét ion :
Đặt số oxi hóa của S là x ta có: 1.x + 4.(-2) = -2 ⇒ x = +6.
Vậy số oxi hóa của S trong ion bằng +6.
Bài 2 trang 79 Hóa học 10: Lập phương trình hóa học của các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử trong mỗi trường hợp.
a) HCl + MnO2 MnCl2 + Cl2↑ + H2O
b) KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O
c) Fe3O4 + HNO3 → Fe(NO3)3 + NO↑ + H2O
d) H2C2O2 + KMnO4 + H2SO4 → CO2↑ + MnSO4 + K2SO4 + H2O
Lời giải:
a) HCl + MnO2 MnCl2 + Cl2↑ + H2O
Bước 1:
Chất khử: HCl
Chất oxi hóa: MnO2
Bước 2: Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
4HCl + MnO2 MnCl2 + Cl2↑ + 2H2O
b) KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O
Bước 1:
Chất khử: KNO2
Chất oxi hóa: KMnO4
Bước 2: Quá trình khử:
Quá trình oxi hóa:
Bước 3:
Bước 4:
2KMnO4 + 5KNO2 + 3H2SO4 → 2MnSO4 + 5KNO3 + K2SO4 + 3H2O
c) Fe3O4 + HNO3 → Fe(NO3)3 + NO↑ + H2O
Bước 1:
Chất khử: Fe3O4
Chất oxi hóa: HNO3
Bước 2: Quá trình khử:
Quá trình oxi hóa:
Bước 3:
Bước 4:
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO↑ + 14H2O
d) H2C2O2 + KMnO4 + H2SO4 → CO2↑ + MnSO4 + K2SO4 + H2O
Bước 1:
Chất khử: H2C2O2
Chất oxi hóa: KMnO4
Bước 2: Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
5H2C2O2 + 6KMnO4 + 9H2SO4 → 10CO2↑ + 6MnSO4 + 3K2SO4 + 14H2O
Bài 3 trang 79 Hóa học 10: Có nhiều hiện tượng xảy ra xung quanh ta, em hãy nêu hai phản ứng oxi hóa - khử gắn liền với cuộc sống hàng ngày và lập phương trình hóa học của các phản ứng đó bằng phương pháp thăng bằng electron.
Lời giải:
1. Phản ứng đốt methane – thành phần chính trong khí biogas:
CH4 + O2 CO2 + H2O
Bước 1:
Chất khử: CH4
Chất oxi hóa: O2
Bước 2: Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4: CH4 + 2O2 CO2 + 2H2O
2. Phản ứng đốt cháy than để đun nấu:
C + O2 CO2
Bước 1:
Chất khử: C
Chất oxi hóa: O2
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4: C + O2 CO2
Bài 4 trang 79 Hóa học 10: Viết phương trình hóa học của phản ứng điều chế muối zinc chloride (ZnCl2) bằng một phản ứng oxi hóa - khử và một phản ứng không phải là phản ứng oxi hóa - khử.
Lời giải:
- Phản ứng oxi hóa - khử:
Zn + Cl2 → ZnCl2
- Phản ứng không phải là oxi hóa khử:
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
Bài 5 trang 79 Hóa học 10: Nhiên liệu rắn dành cho tên lửa tăng tốc của tàu vũ trụ con thoi là hỗn hợp gồm ammonium perchlorate (NH4ClO4) và bột nhôm. Khi được đốt đến trên 200oC, ammonium perchlorate nổ theo phản ứng sau:
NH4ClO4 N2↑ + Cl2↑ + O2↑ + H2O↑
Lập phương trình hóa học của phản ứng bằng phương pháp thăng bằng electron.
Lời giải:
Bước 1:
NH4ClO4 vừa là chất khử vừa là chất oxi hóa.
Bước 2: Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4:
2NH4ClO4 N2 + Cl2 + 2O2 + 4H2O
Bài viết liên quan
- Giải Hoá học 10 Chân trời sáng tạo Bài 10: Liên kết cộng hóa trị
- Giải Hoá học 10 Chân trời sáng tạo Bài 11: Liên kết hydrogen và tương tác van der Waals
- Giải Hoá học 10 Chân trời sáng tạo Bài 13 Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
- Giải Hoá học 10 Chân trời sáng tạo Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
- Giải Hoá học 10 Chân trời sáng tạo Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
