Giải Hoá học 10 Chân trời sáng tạo Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Hamchoi.vn trân trọng giới thiệu: lời giải bài tập Hoá học lớp 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá học 10 Bài 15. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Mở đầu trang 94 Hóa học 10: Trong tự nhiên có những phản ứng xảy ra rất nhanh, như phản ứng nổ của pháo hoa, phản ứng cháy của que diêm, … nhưng cũng có những phản ứng xảy ra chậm hơn, như quá trình oxi hóa các kim loại sắt, đồng trong khí quyển, sự ăn mòn vỏ tàu biển làm bằng thép,… Để đánh giá mức độ nhanh hay chậm của một phản ứng hóa học cần dùng đại lượng nào? Cách tính ra sao?

Lời giải:
Để đánh giá mức độ nhanh hay chậm của một phản ứng hóa học ta dùng đại lượng tốc độ phản ứng hóa học.
- Xét phản ứng đơn giản có dạng: aA + bB → cC + dD
+ Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hóa học được biểu diễn bằng biểu thức:
Trong đó:
k là hằng số tốc độ phản ứng;
CA; CB là nồng độ (M) chất A, B tại thời điểm đang xét.
+ Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng:
Trong đó:
: tốc độ trung bình của phản ứng
∆C = C2 – C1: sự biến thiên nồng độ
∆t = t2 – t1 : biến thiên thời gian
C1, C2 là nồng độ của một chất tại hai thời điểm tương ứng t1 và t2.
1. Tốc độ phản ứng
Câu hỏi 1 trang 94 Hóa học 10: Quan sát hình trong phần Khởi động, nhận xét về mức độ nhanh hay chậm của phản ứng hóa học xảy ra trong đám cháy lá cây khô và thân tàu biển bị oxi hóa trong điều kiện tự nhiên

Lời giải:
Quá trình cháy của lá cây khô diễn ra nhanh, tức thời, dễ quan sát; Quá trình oxi hóa thân tàu biển trong điều kiện tự nhiên diễn ra chậm, khó quan sát trong thời gian ngắn.
Câu hỏi 2 trang 95 Hóa học 10: Trong tự nhiên và cuộc sống, ở cùng điều kiện, nhiều chất khác nhau sẽ biến đổi hóa học nhanh, chậm khác nhau; với cùng một chất, trong điều kiện khác nhau cũng biến đổi hóa học nhanh, chậm khác nhau. Tìm các ví dụ minh họa cho 2 nhận định trên.
Lời giải:
- Ở cùng điều kiện, nhiều chất khác nhau sẽ biến đổi hóa học nhanh, chậm khác nhau.
Ví dụ: Trong cùng một môi trường:
+ Phản ứng đốt cháy khí gas xảy ra nhanh;
+ Phản ứng oxi hóa kim loại ở kiềng bếp gas xảy ra chậm hơn.
- Với cùng một chất, trong điều kiện khác nhau cũng biến đổi hóa học nhanh, chậm khác nhau.
Ví dụ:
+ Than đá có kích thước nhỏ dễ cháy hơn than đá có kích thước lớn trong cùng một điều kiện;
+ Cơm để trong tủ lạnh sẽ lâu bị thiu hơn cơm để ngoài môi trường nóng.
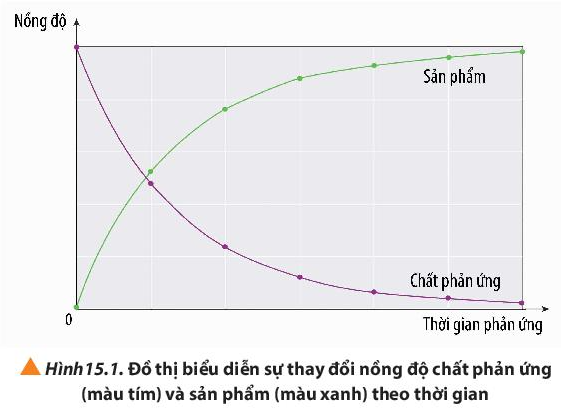
Câu hỏi 3 trang 95 Hóa học 10: Quan sát Hình 15.1, cho biết nồng độ của chất phản ứng và sản phẩm thay đổi như thế nào theo thời gian.
Lời giải:
- Nồng độ của chất phản ứng giảm dần theo thời gian.
- Nồng độ của chất sản phẩm tăng dần theo thời gian.
Luyện tập trang 95 Hóa học 10: Xét phản ứng phân hủy N2O5 ở 45oC
N2O5(g) → N2O4(g) + O2(g)
Sau 184 giây đầu tiên, nồng độ của N2O4 là 0,25M. Tính tốc độ trung bình của phản ứng theo N2O4 trong khoảng thời gian trên
Lời giải:
= 1,36.10-3 (M/s)
Vậy tốc độ trung bình của phản ứng theo N2O4 trong 184 giây đầu tiên là 1,36.10-3 (M/s)
2. Biểu thức tốc độ phản ứng
Câu hỏi 4 trang 96 Hóa học 10: Theo định luật tác dụng khối lượng, tốc độ phản ứng thay đổi như thế nào khi tăng hoặc giảm nồng độ chất phản ứng
Lời giải:
Theo định luật tác dụng khối lượng tốc độ phản ứng tỉ lệ thuận với nồng độ các chất tham gia phản ứng ⇒ Tốc độ phản ứng tăng khi tăng nồng độ chất phản ứng và ngược lại.
Câu hỏi 5 trang 96 Hóa học 10: Trong tự nhiên và cuộc sống, có nhiều phản ứng hóa học xảy ra với tốc độ khác nhau phụ thuộc vào nồng độ chất phản ứng, tìm các ví dụ minh họa
Lời giải:
+ Đám cháy nhỏ sẽ bùng nhanh thành đám cháy lớn khi có gió, gió làm tăng nồng độ oxygen cho sự cháy;
+ Để tăng nhiệt lượng của quá trình đun nấu bằng bếp gas: mở van khí để lượng khí cung cấp từ bình gas nhiều hơn, tốc độ phản ứng cháy diễn ra nhanh, cung cấp nhiệt lượng cao hơn.
Luyện tập trang 96 Hóa học 10: Cho phản ứng đơn giản sau:
H2(g) + Cl2(g) → 2HCl(g)
a) Viết biểu thức tốc độ tức thời của phản ứng trên
b) Tốc độ phản ứng thay đổi thế nào khi nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2?
Lời giải:
H2(g) + Cl2(g) → 2HCl(g)
a) Biểu thức tốc độ tức thời của phản ứng viết theo định luật là:
b) Nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2
⇒
Vậy tốc độ phản ứng giảm một nửa khi nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2.
Vận dụng trang 96 Hóa học 10: Dưới đây là một số hiện tượng xảy ra trong đời sống, hãy sắp xếp theo thứ tự tốc độ giảm dần:
Nướng bánh mì (1)
Đốt gas khi nấu ăn (2)
Lên men sữa chua tạo sữa chua (3)
Tấm tôn thiếc bị gỉ sét (4)
Lời giải:
Sắp xếp theo thứ tự tốc độ giảm dần: (2) > (1) > (3) > (4)
Bài 1 trang 97 Hóa học 10: Cho phản ứng đơn giản xảy ra trong bình kín: 2NO(g) + O2(g) → 2NO2(g)
a) Viết biểu thức tốc độ tức thời của phản ứng
b) Ở nhiệt độ không đổi, tốc độ phản ứng thay đổi thế nào khi
- nồng độ O2 tăng 3 lần, nồng độ NO không đổi?
- nồng độ NO tăng 3 lần, nồng độ O2 không đổi?
- nồng độ NO và O2 đều tăng 3 lần?
Lời giải:
a) Biểu thức tốc độ tức thời của phản ứng:
b) - nồng độ O2 tăng 3 lần, nồng độ NO không đổi
⇒ Tốc độ phản ứng tăng 3 lần.
- nồng độ NO tăng 3 lần, nồng độ O2 không đổi
⇒ Tốc độ phản ứng tăng 9 lần.
- nồng độ NO và O2 đều tăng 3 lần
⇒ Tốc độ phản ứng tăng 27 lần.
Bài 2 trang 197 Hóa học 10: Giải thích tại sao tốc độ tiêu hao của NO (M/s) và tốc độ tạo thành của N2 (M/s) không giống nhau trong phản ứng:
2CO(g) + 2NO(g) → 2CO2(g) + N2(g)
Lời giải:
Tốc độ trung bình của phản ứng trong một đơn vị thời gian ∆t là:
(Dấu “ – “ biểu diễn cho chất tham gia bị giảm sau phản ứng)
Vậy trong phản ứng trên, tốc độ tiêu hao của NO gấp 2 lần tốc độ tạo thành N2.
Bài 3 trang 97 Hóa học 10: Cho phản ứng:
2N2O5(g) → 4NO2(g) + O2(g)
Sau thời gian từ giây 61 đến giây 120, nồng độ NO2 tăng từ 0,30 M lên 0,40 M. Tính tốc độ trung bình của phản ứng.
Lời giải:
Tốc độ trung bình của phản ứng là:
Bài 4 trang 97 Hóa học 10: Dữ liệu thí nghiệm của phản ứng:
SO2Cl2(g) → SO2(g) + Cl2(g) được trình bày ở bảng sau

a) Tính tốc độ trung bình của phản ứng theo SO2Cl2 trong thời gian 100 phút.
b) Sau 100 phút, nồng độ của SO2Cl2 còn lại là bao nhiêu?
c) Sau 200 phút, nồng độ của SO2 và Cl2 thu được là bao nhiêu?
Lời giải:
a) Tốc độ trung bình của phản ứng theo SO2Cl2 trong thời gian 100 phút.
(M/phút)
b) Sau 100 phút, nồng độ của SO2Cl2 còn lại là 1,00 – 0,13 = 0,87 M
c) Sau 200 phút, nồng độ của SO2Cl2 còn lại là: 0,78 M
⇒ Nồng độ của SO2Cl2 đã phản ứng là: 1,00 – 0,78 = 0,22 M
⇒ Nồng độ của SO2 và Cl2 thu được là 0,22 M
Bài viết liên quan
- Giải Hoá học 10 Chân trời sáng tạo Bài 13 Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
- Giải Hoá học 10 Chân trời sáng tạo Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
- Giải Hoá học 10 Chân trời sáng tạo Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
- Giải Hoá học 10 Chân trời sáng tạo Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
- Giải Hoá học 10 Chân trời sáng tạo Bài 18: Hydrogen halide và một số phản ứng của ion halide
