Giải Hoá học 10 Chân trời sáng tạo Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Hamchoi.vn trân trọng giới thiệu: lời giải bài tập Hoá học lớp 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hoá học 10 Bài 16. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Mở đầu trang 98 Hóa học 10: Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn (a), khi nấu một loại thực phẩm bằng nồi áp suất sẽ nhanh chín hơn (b), bệnh nhân sẽ dễ hô hấp hơn khi dùng oxygen từ bình chứa khí oxygen so với từ không khí (c), …

Những yếu tố nào ảnh hưởng đến tốc độ của các quá trình biến đổi trên.
Lời giải:
(a) Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn ⇒ Ảnh hưởng của nhiệt độ đến tốc độ phản ứng.
(b) Khi nấu một loại thực phẩm bằng nồi áp suất sẽ nhanh chín hơn ⇒ Ảnh hưởng của áp suất đến tốc độ phản ứng.
(c) Bệnh nhân sẽ dễ hô hấp hơn khi dùng oxygen từ bình chứa khí oxygen so với từ không khí ⇒ Ảnh hưởng của nồng độ đến tốc độ phản ứng.
1. Ảnh hưởng của nồng độ
Câu hỏi 1 trang 98 Hóa học 10: Tiến hành thí nghiệm 1 và quan sát hiện tượng của thí nghiệm. Nhận xét mối liên hệ giữa thể tích dung dịch Na2S2O3 với thời gian xuất hiện kết tủa.
Thí nghiệm 1: Ảnh hưởng của nồng độ đến tốc độ phản ứng
Hóa chất: Dung dịch sodium thiosulfate (Na2S2O3) 0,15M; sulfuric acid (H2SO4) 0,10M; nước cất.
Dụng cụ: cốc thủy tinh 100 mL (được đánh dấu thập ở mặt ngoài đáy cốc), ống đong 50 mL.
Tiến hành:
Bước 1: Pha loãng dung dịch Na2S2O3 0,15 M để được các dung dịch có nồng độ khác nhau theo Bảng 16.1.
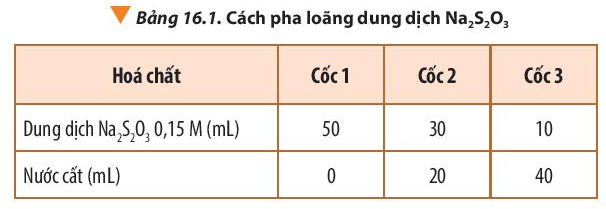
Bước 2: Rót đồng thời 10 mL dung dịch H2SO4 0,1 M vào mỗi cốc và khuấy đều.
Phương trình hóa học của phản ứng:
Na2S2O3(aq) + H2SO4(aq) → Na2SO4(aq) + S(s) + SO2(g) + H2O(l)
Lời giải:
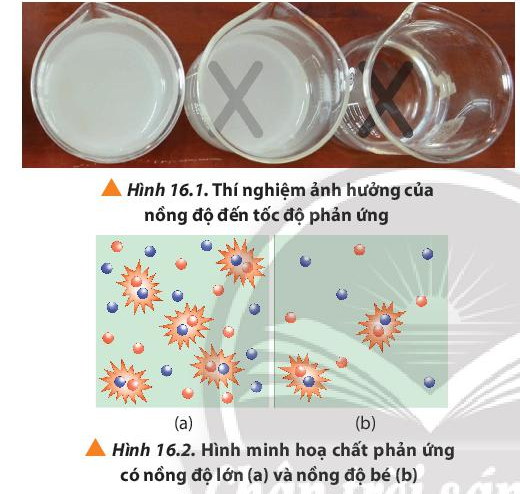
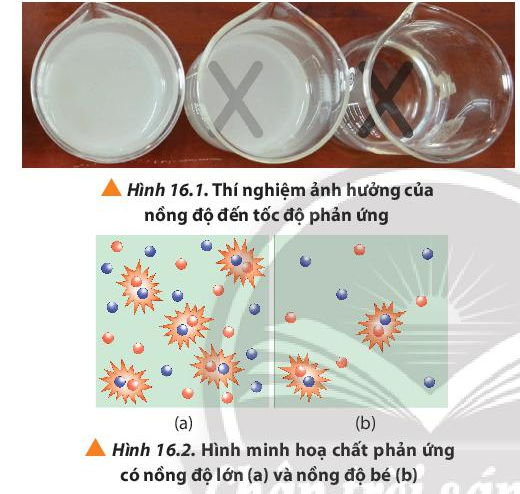
Khi rót dung dịch H2SO4 vào cốc đựng dung dịch Na2S2O3 theo trình tự từ cốc 1 đến cốc 3, cốc 1 có lượng S tạo ra nhiều làm mờ dấu thập nhanh nhất, chậm dần ở các cốc còn lại.
Nhận xét: Thể tích của dung dịch Na2S2O3 0,15M càng giảm, tốc độ phản ứng càng chậm.
Câu hỏi 2 trang 98 Hóa học 10: Quan sát Hình 16.2 và phương trình hóa học của phản ứng, giải thích kết quả thí nghiệm 1.
Na2S2O3(aq) + H2SO4(aq) → Na2SO4(aq) + S(s) + SO2(g) + H2O(l)
Lời giải:
Nồng độ Na2S2O3 giảm ⇒ Số va chạm hiệu quả giữa các phân tử Na2S2O3 và phân tử H2SO4 giảm ⇒ Kết tủa tạo thành chậm tức là tốc độ phản ứng chậm hơn.
Luyện tập trang 99 Hóa học 10: Giữ nguyên nồng độ dung dịch Na2S2O3 ban đầu, pha loãng dung dịch H2SO4 tương tự như cách pha loãng dung dịch Na2S2O3 theo Bảng 16.1, kết quả thí nghiệm sẽ thay đổi thế nào?
Lời giải:
Pha loãng dung dịch H2SO4 ⇒ Nồng độ H2SO4 giảm ⇒ Số va chạm hiệu quả giữa các phân tử Na2S2O3 và phân tử H2SO4 giảm ⇒ Kết tủa tạo thành chậm tức là tốc độ phản ứng chậm hơn.
2. Ảnh hưởng của nhiệt độ
Câu hỏi 3 trang 99 Hóa học 10: Quan sát Hình 16.3, nhận xét sự ảnh hưởng của nhiệt độ đến tốc độ phản ứng.

Lời giải:
Trong cùng một khoảng thời gian, cốc (1) được đun nóng bị mất màu, cốc (2) không được đun nóng màu chỉ nhạt hơn. Chứng tỏ nhiệt độ cao hơn đã làm phản ứng ở cốc (1) xảy ra nhanh hơn.
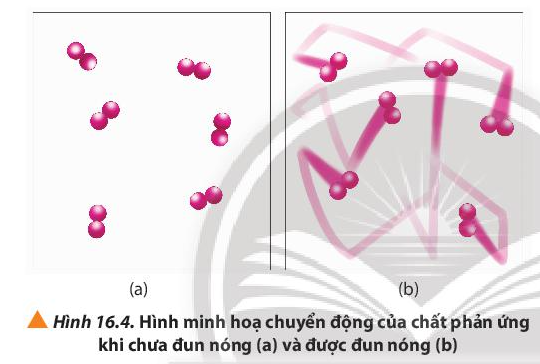
Câu hỏi 4 trang 100 Hóa học 10: Quan sát Hình 16.4 và phương trình hóa học của phản ứng, giải thích vì sao tốc độ mất màu của KMnO4 trong 2 cốc không giống nhau.
Lời giải:
Khi đun nóng, các phân tử chất chuyển động với vận tốc nhanh hơn dẫn đến sự gia tăng số va chạm hiệu quả giữa các phân tử, do đó tốc độ phản ứng tăng.
Luyện tập trang 100 Hóa học 10: Biết rằng, khi nhiệt độ tăng thêm 10oC, tốc độ của một phản ứng hóa học tăng 4 lần; cho biết tốc độ phản ứng giảm bao nhiêu lần khi nhiệt độ giảm từ 70oC xuống 40oC
Lời giải:
Khi nhiệt độ tăng thêm 10oC, tốc độ của một phản ứng hóa học tăng 4 lần
⇒ γ = 4
Khi nhiệt độ giảm từ 70oC xuống 40oC thì tốc độ phản ứng giảm 64 lần.
3. Ảnh hưởng của áp suất
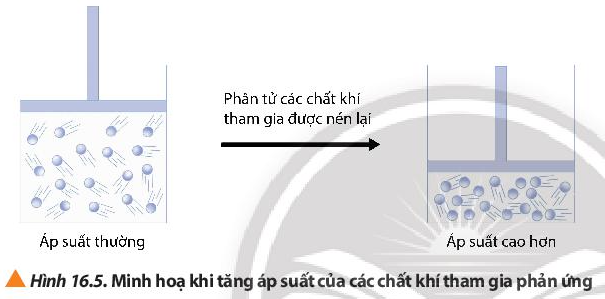
Câu hỏi 5 trang 101 Hóa học 10: Quan sát Hình 16.5, cho biết mật độ phân bố của các phân tử chất khí trong bình kín thay đổi như thế nào khi tăng áp suất của bình?
Lời giải:
Khi nén, áp suất trong bình kín tăng, thể tích giảm, các phân tử chất khí phân bố với độ đặc khít cao hơn, nồng độ cao hơn, các chất dễ va chạm hiệu quả hơn dẫn đến tốc độ phản ứng tăng.
Luyện tập trang 101 Hóa học 10: Xét các phản ứng xảy ra trong bình kín:
2CO(g) + O2(g) → 2CO2(g) (1)
NH4Cl(s) → NH3(g) + HCl(g) (2)
Yếu tố áp suất ảnh hưởng đến tốc độ của phản ứng nào? Khi tăng áp suất, tốc độ phản ứng thay đổi như thế nào?
Lời giải:
Trong phản ứng hóa học có sự tham gia của chất khí, áp suất có thể ảnh hưởng đến tốc độ phản ứng.
Yếu tố áp suất ảnh hưởng đến tốc độ của phản ứng (1). Khi tăng áp suất tốc độ phản ứng tăng.
4. Ảnh hưởng của bề mặt tiếp xúc
Câu hỏi 6 trang 101 Hóa học 10: Tiến hành thí nghiệm 2 và so sánh tốc độ khí thoát ra trong hai bình tam giác.
Thí nghiệm 2: Ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứng
Hóa chất: Dung dịch HCl 1 M, đá vôi (CaCO3) dạng khối và dạng hạt nhỏ.
Dụng cụ: bình tam giác 100 mL, ống đong 50 mL, cân.
Tiến hành:
Bước 1: Cân khoảng 2 g CaCO3, mỗi loại, cho vào 2 bình tam giác (1), (2).
Bước 2: Đong khoảng 20 mL dung dịch HCl, rót đồng thời vào mỗi bình tam giác.
Phương trình hóa học của phản ứng:
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)

Lời giải:
Bình (1) chứa đá vôi dạng khối.
Bình (2) chứa đá vôi dạng hạt.
Nhận thấy khí thoát ra ở bình (2) nhanh hơn khí thoát ra ở bình (1).
Câu hỏi 7 trang 101 Hóa học 10: Nhận xét mối liên hệ giữa tốc độ phản ứng với kích thước của CaCO3.
Lời giải:
Kích thước của hạt đá vôi (CaCO3) càng nhỏ thì tốc độ phản ứng càng lớn.
Do CaCO3 có kích thước nhỏ sẽ có bề mặt tiếp xúc với dung dịch HCl lớn hơn so với CaCO3 kích thước lớn (cùng khối lượng), làm tăng tần số va chạm giữa các chất phản ứng, dẫn đến tốc độ phản ứng tăng.
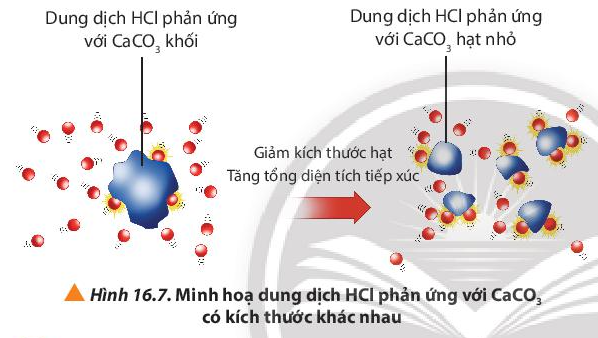
Câu hỏi 8 trang 101 Hóa học 10: Quan sát Hình 16.7, giải thích kết quả của thí nghiệm 2.
Lời giải:
CaCO3 có kích thước nhỏ sẽ có bề mặt tiếp xúc với dung dịch HCl lớn hơn so với CaCO3 kích thước lớn (cùng khối lượng), làm tăng tần số va chạm giữa các chất phản ứng, dẫn đến tốc độ phản ứng tăng.
Luyện tập trang 102 Hóa học 10: Củi khi được chẻ nhỏ sẽ cháy nhanh hơn và mạnh hơn so với củi có kích thước lớn. Giải thích.
Lời giải:
Củi được chẻ nhỏ có diện tích tiếp xúc giữa củi (nhiên liệu) với oxygen trong không khí lớn hơn, làm tăng khả năng phản ứng cháy với oxygen, tốc độ phản ứng tăng.
5. Ảnh hưởng của chất xúc tác
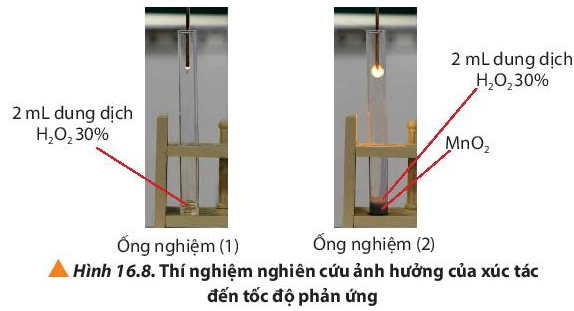
Câu hỏi 9 trang 102 Hóa học 10: Tiến hành thí nghiệm 3, quan sát hiện tượng và so sánh sự thay đổi của tàn đóm ở 2 ống nghiệm.
Thí nghiệm 3: Ảnh hưởng của xúc tác đến tốc độ phản ứng
Hóa chất: dung dịch hydrogen peroxide (H2O2) 30%, bột MnO2.
Dụng cụ: Ống nghiệm, tàn đóm đỏ.
Tiến hành:
Bước 1: Rót khoảng 2 mL dung dịch H2O2 vào 2 ống nghiệm (1), (2).
Bước 2: Thêm một ít bột MnO2 vào ống nghiệm (2) và đưa nhanh tàn đóm đỏ vào miệng 2 ống nghiệm (Hình 16.8).
Phương trình hóa học của phản ứng:
2H2O2(aq) 2H2O(l) + O2(g)
Lời giải:
Hiện tượng:
- Tàn đóm ở ồng nghiệm (1) chỉ cháy nhẹ.
- Tàn đóm ở ống nghiệm (2) bùng cháy mãnh liệt hơn.
Luyện tập trang 103 Hóa học 10: Tại sao nhai kĩ cơm, cảm nhận cơm có vị ngọt hơn?
Lời giải:
Thành phần chính của cơm là tinh bột, (C6H10O5)n, khi nhai kĩ cơm, tuyến nước bọt cung cấp enzyme amylase, có vai trò là chất xúc tác, chuyển hóa tinh bột thành đường glucose có vị ngọt.
6. Ý nghĩa thực tiễn của tốc độ phản ứng trong đời sống và sản xuất
Câu hỏi 10 trang 103 Hóa học 10: Quan sát Hình 16.9, cho biết yếu tố nào ảnh hưởng đến tốc độ phản ứng đã được vận dụng trong thực tiễn.

Lời giải:
- Hình 16.9a) Vận dụng yếu tố ảnh hưởng của nồng độ đến tốc độ phản ứng: Nồng độ oxygen trong không khí chỉ chiếm 21%. Dùng bình chứa oxygen mục đích làm tăng nồng độ chất tham gia ⇒ tăng tốc độ phản ứng cháy, sinh ra lượng nhiệt lớn để hàn, cắt kim loại.
- Hình 16.9b) Vận dụng yếu tố ảnh hưởng của áp suất đến tốc độ phản ứng: Dùng nồi áp suất làm tăng áp suất trong nồi ⇒ tăng tốc độ phản ứng ⇒ làm thức ăn nhanh chín hơn.
- Hình 16.9c) Vận dụng yếu tố ảnh hưởng của diện tích tiếp xúc đến tốc độ phản ứng: Đậy nắp lò làm giảm diện tích tiếp xúc của than với oxygen trong không khí ⇒ giảm tốc độ phản ứng cháy ⇒ than cháy được lâu hơn.
- Hình 16.9d) Vận dụng yếu tố ảnh hưởng của nhiệt độ đến tốc độ phản ứng: Bảo quản thức ăn trong tủ lạnh ⇒ giảm nhiệt độ ⇒ giảm tốc độ phản ứng oxi hóa thức ăn ⇒ thức ăn lâu bị ôi thiu.
Vận dụng trang 104 Hóa học 10: Trong quá trình lên men giấm, người ta thường cho chuối hay nước dừa vào lọ chứa giấm nuôi, giải thích.
Lời giải:
Vi sinh vật lên men ethanol thành giấm. Trong điều kiện thích hợp, vi sinh vật lên men chuối chín hay nước dừa (thành phần chính có đường glucose) chuyển hóa thành ethanol và tạo ra acetic acid (thành phần của giấm ăn). Thêm chuối chín, nước dừa hoặc một số loại trái cây khác, gián tiếp bổ sung ethanol cho quá trình lên men, đồng thời tạo ra mùi vị đặc trưng cho loại giấm đó.
Bài 1 trang 104 Hóa học 10: Hai nhân vật minh họa trong hình bên đang chế biến món gà rán, được thực hiện bằng hai cách. Một người chọn cách chia ra từng phần nhỏ, người còn lại chọn cách để nguyên, giả thiết các điều kiện đều giống nhau (nhiệt độ, lượng dầu ăn,…). Hãy cho biết cách nào món ăn nhanh chín hơn? Giải thích

Lời giải:
Trong điều kiện giống nhau (nhiệt độ, lượng dầu ăn …) thì chế biến món gà rán bằng cách chia từng phần nhỏ làm tăng diện tích tiếp xúc của gà với chảo dầu nóng ⇒ giúp gà nhanh chín hơn.
Bài 2 trang 104 Hóa học 10: Nồng độ, nhiệt độ, áp suất, diện tích tiếp xúc, chất xúc tác ảnh hưởng như thế nào đến tốc độ phản ứng.
Lời giải:
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
- Khi tăng nhiệt độ, tốc độ phản ứng tăng
- Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học, nhưng vẫn được bảo toàn về chất lượng khi kết thúc phản ứng
Bài 3 trang 104 Hóa học 10: Cho a g kim loại Zn dạng hạt vào lượng dư dung dịch HCl 2M, phương trình hóa học xảy ra như sau:
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Tốc độ khí H2 thoát ra như thế nào khi thay đổi các yếu tố dưới đây
a) Thay a g Zn hạt bằng a g bột Zn
b) Thay dung dịch HCl 2M bằng dung dịch HCl 1M
c) Thực hiện phản ứng ở nhiệt độ cao hơn bằng cách đun nóng nhẹ dung dịch HCl.
Lời giải:
a) Thay a g Zn hạt bằng a g bột Zn ⇒ diện tích tiếp xúc của chất phản ứng tăng ⇒ tốc độ phản ứng tăng ⇒ khí H2 thoát ra nhanh hơn.
b) Thay dung dịch HCl 2M bằng dung dịch HCl 1M ⇒ nồng độ chất tham gia giảm ⇒ tốc độ phản ứng giảm ⇒ khí H2 thoát ra chậm hơn.
c) Thực hiện phản ứng ở nhiệt độ cao hơn bằng cách đun nóng nhẹ dung dịch HCl ⇒ tăng nhiệt độ của phản ứng⇒ tốc độ phản ứng tăng ⇒ khí H2 thoát ra nhanh hơn.
Bài 4 trang 104 Hóa học 10: Cho phương trình hóa học của phản ứng:
2CO(g) + O2(g) → 2CO2(g)
Nếu hệ số nhiệt độ Van’t Hoff bằng 2, tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ của phản ứng từ 30oC lên 60oC?
Lời giải:
Hệ số nhiệt độ Van’t Hoff γ = 2.
Khi tăng nhiệt độ của phản ứng từ 30oC lên 60oC tốc độ phản ứng tăng 8 lần.
Bài viết liên quan
- Giải Hoá học 10 Chân trời sáng tạo Bài 13 Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
- Giải Hoá học 10 Chân trời sáng tạo Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
- Giải Hoá học 10 Chân trời sáng tạo Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
- Giải Hoá học 10 Chân trời sáng tạo Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
- Giải Hoá học 10 Chân trời sáng tạo Bài 18: Hydrogen halide và một số phản ứng của ion halide
