Một ion X2+ có tổng số hạt proton, nơtron, electron là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 20. Số hạt nơtron và electron trong nguyên tử X lần lượt là
A. 36 và 27.
B. 36 và 29.
C. 29 và 36.
D. 27 và 36.
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án B
Gọi số hạt proton, nơtron và electron trong X lần lượt là p, n và e.
Tổng số các loại hạt proton, nơtron và electron của X2+ là 92:
p + n + e – 2 = 92 2p + n = 94 (1)
Tổng số hạt mang điện gấp nhiều hơn số hạt không mang điện là 20
(p + e – 2) – n = 20 hay 2p – n = 22 (2)
Từ (1), (2) ta có p = e = 29 , n = 36
Gói VIP thi online tại VietJack (chỉ 400k/1 năm học), luyện tập gần 1 triệu câu hỏi có đáp án chi tiết
Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố X là 10. Số khối của nguyên tử X là
Một nguyên tử R có tổng số hạt mang điện và không mang điện là 34, trong đó số hạt mang điện gấp 1,833 lần số hạt không mang điện.Nguyên tố R và cấu hình electron là ?
Cho ba nguyên tử có kí hiệu là , , . Phát biểu nào sau đây là sai?
Nguyên tử R có tống số hạt cơ bản là 52, trong đó số hạt không mang điện trong hạt nhân gấp 1,059 lần số hạt mang điện tích âm. Kết luận nào sau đây không đúng với R?
Chọn câu phát biểu sai:
1. Trong một nguyên tử luôn luôn có số proton = số electron = số đơn vị điện tích hạt nhân
2. Tổng số proton và số electron trong một hạt nhân gọi là số khối
3. Số khối A là khối lượng tuyệt đối của nguyên tử
4. Số proton = số đơn vị điện tích hạt nhân
5. Đồng vị là các nguyên tử có cùng số proton nhưng khác nhau về số nơtron
Một nguyên tố X có 3 đồng vị (79%), (10%), (11%). Biết tổng số khối của 3 đồng vị là 75, nguyên tử khối trung bình của 3 đồng vị là 24,32. Mặt khác số nơtron của đồng vị thứ 2 nhiều hơn số nơtron đồng vị 1 là 1 đơn vị . A1, A2, A 3 lần lượt là:
Nguyên tử của nguyên tố Y được cấu tạo bởi 36 hạt, trong đó số hạt mang điện gấp đôi số hạt không mang điện. Cấu hình electron của Y là
Nguyên tử của nguyên tố R có tổng số hạt p, n, e bằng 18. Số hạt không mang điện bằng trung bình cộng của tổng số hạt mang điện. Vậy số electron độc thân của nguyên tử R ở trạng thái cơ bản là
M và X là hai nguyên tử kim loại, tổng số hạt cơ bản của cả nguyên tử M và X là 142, trong đó tổng số hạt mang điện nhiều hơn không mang điện là 42. Số hạt mang điện trong nguyên tử M nhiều hơn trong nguyên tử X là 12. Tìm M và X
Nguyên tử của nguyên tố X có tống số hạt cơ bản là 49, trong đó số hạt không mang điện bằng 53,125% số hạt mang điện. Số đơn vị điện tích hạt nhân của X là
Nguyên tố Cu có nguyên tử khối trung bình là 63,54 có 2 đồng vị X và Y. Biết tổng số khối của hai đồng vị là 128. Số nguyên tử đồng vị X bằng 0,37 số nguyên tử đồng vị Y. Vậy phần trăm số nguyên tử của từng đồng vị là
Trong tự nhiên Oxi có 3 đồng vị 16O (x1%), 17O (x2%), 18O (4%), nguyên tử khối trung bình của Oxi là 16,14. Phần trăm đồng vị 16O và 17O lần lượt là:
Nguyên tử của nguyên tố nào sau đây khi nhận thêm 1e thì đạt cấu hình e của Ne (Z = 10).
Cấu hình electron lớp ngoài cùng của nguyên tử X phân bố như sau:
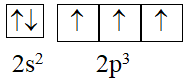
Số hiệu nguyên tử và kí hiệu nguyên tử X là
Nguyên tử của nguyên tố R có 3 lớp e, lớp ngoài cùng có 3e. Vậy số hiệu nguyên tử của nguyên tố R là: