Giải Hóa 10 Kết nối tri thức Bài 4: Ôn tập chương 1
Hamchoi.vn trân trọng giới thiệu: lời giải bài tập Hóa lớp 10 Bài 4: Ôn tập chương 1 sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa 10 Bài 4. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 4: Ôn tập chương 1
I. Hệ thống hóa kiến thức
Hoàn thành sơ đồ hệ thống hóa kiến thức trang 26 Hóa học 10.
Lời giải:
- Nguyên tử có kích thước: vô cùng nhỏ bé, khối lượng: me + mp + mn; Z = số proton = số electron.
|
|
Hạt neutron |
Hạt proton |
Hạt electron |
|
Khối lượng |
1,675.10–27 kg |
1,672.10–27 kg |
9,109.10–31 kg |
|
Điện tích |
0 |
+1 |
-1 |
- AO s có dạng hình cầu; AO p gồm AO px, AO py, AO pz; AO p có dạng hình số 8 nổi.
|
n |
1 |
2 |
3 |
4 |
|
Lớp electron |
K |
L |
M |
N |
|
Phân lớp |
1s |
2s và 2p |
3s, 3p và 3d |
4s, 4p, 4d và 4f |
|
Số AO |
1 |
4 |
9 |
16 |
|
Số electron tối đa |
2 |
8 |
18 |
32 |
- Thứ tự năng lượng các phân lớp từ thấp đến cao: 1s 2s 2p 3s 3p 4s …
- Cấu hình electron:
|
Đặc điểm của lớp electron ngoài cùng |
||||
|
Số electron |
1, 2, 3 |
4 |
5, 6, 7 |
8 |
|
Loại nguyên tố |
Kim loại |
Kim loại hoặc phi kim |
Thường là phi kim |
Khí hiếm |
+ Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao 1s 2s 2p 3s 3p 4s …
+ Nguyên lí Pauli: Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau.
+ Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
- Nguyên tố hóa học:
+ Số khối (A) = Z + N
+ Kí hiệu nguyên tử:
+ Đồng vị và ⇒ với x1 và x2 lần lượt là phần trăm số nguyên tử của 2 đồng vị.
II. Luyện tập
Câu 1 trang 27 Hóa học 10: Số proton, neutron và electron của lần lượt là
Lời giải:
Đáp án đúng là: C
có:
Số hiệu nguyên tử Z = số proton = số electron = 19
A = Z + N ⇔ N = A – Z = 39 – 19 = 20
Vật số proton, neutron và electron của lần lượt là 19, 20, 19
Câu 2 trang 27 Hóa học 10: Nguyên tử của nguyên tố nào sau đây có 3 electron thuộc lớp ngoài cùng?
Lời giải:
Đáp án C
- Cấu hình electron của Na (Z = 11) là 1s22s22p63s1
⇒ Nguyên tử Na có 1 electron lớp ngoài cùng.
- Cấu hình electron của N (Z = 7) là 1s22s22p3
⇒ Nguyên tử N có 5 electron lớp ngoài cùng.
- Cấu hình electron của Al (Z = 13) là 1s22s22p63s23p1
⇒ Nguyên tử Al có 3 electron lớp ngoài cùng.
- Cấu hình electron của C (Z = 6) là 1s22s22p2
⇒ Nguyên tử C có 4 electron lớp ngoài cùng.
Lời giải:
Đáp án D
Cấu hình electron của potassium là 1s22s22p63s23p64s1
Cấu hình electron của potassium được biểu diễn theo ô orbital như sau:
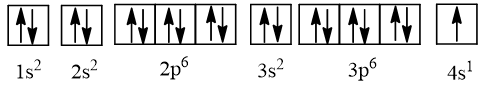
⇒ Potassium có 10 orbital chứa electron.
Câu 4 trang 27 Hóa học 10: Nguyên tử của nguyên tố sodium (natri) (Z = 11) có cấu hình electron là
Lời giải:
Đáp án đúng là: C
Cấu hình electron của nguyên tử sodium (natri) (Z = 11) là 1s22s22p63s1.
Lời giải:
Đáp án đúng là: C
Gọi số hạt proton, neutron và electron trong nguyên tử X lần lượt là p, n và e.
Theo bài ta có:
Tổng số hạt proton, neutron và electron trong nguyên tử X là 58
⇒ p + e + n = 58 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 18
⇒ (p + e) – n = 18 (2)
Nguyên tử trung hòa về điện
⇒ p = e (3)
Giải hệ phương trình (1), (2), (3) ta được: p = e = 19; n = 20
⇒ Số proton = số electron = số hiệu nguyên tử Z = 19
⇒ Vậy X là K (Z = 19)
Lời giải:
Cấu hình electron của chlorine (Z = 17) là 1s22s22p63s23p5.
⇒ Nguyên tử chlorine có 3 lớp electron và 7 electron lớp ngoài cùng.
Cấu hình electron theo ô orbital là
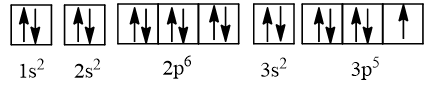
⇒ Số electron độc thân bằng 1.
Lời giải:
Giả sử đồng vị còn lại của V có số khối là A
Phần trăm đồng vị bằng 100% - 0,25% = 99,75%
⇒
⇒ A = 51
Vậy đồng vị còn lại là
Câu 8 trang 27 Hóa học 10: Cấu hình electron của:
- Nguyên tử X: 1s22s22p63s23p64s1;
- Nguyên tử Y: 1s22s22p63s23p4.
a) Mỗi nguyên tử X và Y chứa bao nhiêu electron?
b) Hãy cho biết số hiệu nguyên tử của X và Y.
c) Lớp electron nào trong nguyên tử X và Y có mức năng lượng cao nhất?
d) Mỗi nguyên tử X và Y có bao nhiêu lớp electron, bao nhiêu phân lớp electron?
e) X và Y là nguyên tố kim loại, phi kim hay khí hiếm?
Lời giải:
a) Nguyên tử X chứa 19 electron, nguyên tử Y chứa 16 electron.
b) Số hiệu nguyên tử Z = số proton = số electron.
⇒ Số hiệu nguyên tử của X là 19
Số hiệu nguyên tử của Y là 16
c) Các electron sắp xếp thành từng lớp và phân lớp theo năng lượng từ thấp đến cao.
Trong nguyên tử X: Lớp electron thứ 4 có mức năng lượng cao nhất.
Trong nguyên tử Y: Lớp electron thứ 3 có mức năng lượng cao nhất.
d) Dựa vào cấu hình electron của X và Y, ta có:
- Nguyên tử X có 4 lớp electron và 6 phân lớp electron (1s, 2s, 2p, 3s, 3p, 4s).
- Nguyên tử Y có 3 lớp electron và 5 phân lớp electron (1s, 2s, 2p, 3s, 3p).
e) Nguyên tử X có 1 electron lớp ngoài cùng nên X là kim loại.
Nguyên tử Y có 6 electron lớp ngoài cùng nên Y là phi kim.
Lời giải:
- Nguyên tử của nguyên tố X có cấu hình electron kết thúc ở phân lớp 3p1.
+ Cấu hình electron nguyên tử của X là 1s22s22p63s23p1.
+ Nguyên tố X có 13 electron trong nguyên tử.
+ Lớp ngoài cùng có 3 electron. ⇒ Nguyên tố X là kim loại.
- Nguyên tử của nguyên tố Y có cấu hình electron kết thúc ở phân lớp 3p3.
+ Cấu hình electron nguyên tử của Y là 1s22s22p63s23p3.
+ Nguyên tố Y có 15 electron trong nguyên tử.
+ Lớp ngoài cùng có 5 electron. ⇒ Nguyên tố Y là phi kim.
Lời giải:
Gọi số hạt proton, electron, neutron lần lượt là p, e, n.
Tổng số hạt cơ bản (proton, electron, neutron) là 49
⇒ p + e + n = 49 (1)
Số hạt không mang điện bằng 53,125% số hạt mang điện
⇒ (2)
Mặt khác, nguyên tử trung hòa về điện
⇒ p = e (3)
Giải hệ (1), (2), (3) ta được: p = e = 16; n = 17
Vậy số proton = số electron = 16 hạt, số neutron = 17 hạt
Điện tích hạt nhân là +16 và số khối A = số proton + số neutron = 16 + 17 = 33
Bài viết liên quan
- Giải Hóa 10 Kết nối tri thức Bài 2: Nguyên tố hóa học
- Giải Hóa 10 Kết nối tri thức Bài 3: Cấu trúc lớp vỏ electron nguyên tử
- Giải Hóa 10 Kết nối tri thức Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
- Giải Hóa 10 Kết nối tri thức Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
- Giải Hóa 10 Kết nối tri thức Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
