Giải Hóa 10 Kết nối tri thức Bài 19: Tốc độ phản ứng
Hamchoi.vn trân trọng giới thiệu: lời giải bài tập Hóa lớp 10 Bài 19: Tốc độ phản ứng sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa 10 Bài 19. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 19: Tốc độ phản ứng
Lời giải:
Để so sánh sự nhanh, chậm của các phản ứng hóa học, ta có thể dựa vào tốc độ phản ứng hóa học.
Ta có thể áp dụng nhiều biện pháp, kĩ thuật để thay đổi tốc độ phản ứng như thay đổi nồng độ, nhiệt độ, dùng chất xúc tác,…
I. Tốc độ phản ứng hóa học
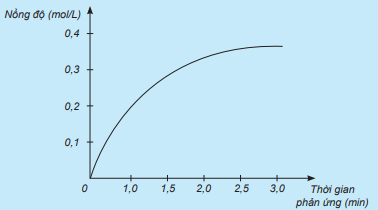
Câu hỏi 1 trang 93 Hóa học 10: Xét phản ứng: H2 + Cl2 → 2HCl.
Nghiên cứu sự thay đổi nồng độ một chất trong phản ứng theo thời gian, thu được đồ thị sau:
a) Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất nào?
b) Nêu đơn vị của tốc độ phản ứng trong trường hợp này.
Lời giải:
a) Dựa vào đồ thị ta thấy: Nồng độ ban đầu của chất là 0 mol/L. Thời gian của phản ứng tăng, nồng độ dung dịch chất tăng.
⇒ Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất sản phẩm HCl.
b) Đơn vị của tốc độ phản ứng trong trường hợp này là mol/(L.min).
Hoạt động trang 93 Hóa học 10: Phản ứng phân hủy H2O2:
Kết quả thí nghiệm đo nồng độ H2O2 tại các thời điểm khác nhau được trình bày trên Bảng 19.1.
Bảng 19.1. Kết quả thí nghiệm phản ứng phân hủy H2O2
Biến thiên nồng độ trong khoảng thời gian từ 0 giờ đến 3 giờ là:
0,707 – 1,000 = – 0,293 (mol/L)
(Dấu "–" thể hiện rằng nồng độ H2O2 giảm dần khi phản ứng xảy ra.)
Tốc độ phản ứng trong khoảng thời gian từ 0 giờ đến 3 giờ được tính như sau:
(Đặt dấu "–" trước biểu thức để tốc độ phản ứng có giá trị dương.)
1. Hãy tính tốc độ phản ứng theo nồng độ H2O2 trong các khoảng thời gian từ:
a) 3 giờ đến 6 giờ; b) 6 giờ đến 9 giờ c) 9 giờ đến 12 giờ.
2. Nhận xét về sự thay đổi tốc độ phản ứng theo thời gian.
Lời giải:
1. a) Tốc độ phản ứng trong khoảng thời gian từ 3 giờ đến 6 giờ là:
= (mol/ (L.h))
b) Tốc độ phản ứng trong khoảng thời gian từ 6 giờ đến 9 giờ là:
= (mol/ (L.h))
c) Tốc độ phản ứng trong khoảng thời gian từ 9 giờ đến 12 giờ là:
= (mol/ (L.h))
2. Nhận xét về sự thay đổi tốc độ phản ứng theo thời gian: Tốc độ phản ứng giảm dần theo thời gian.
Câu hỏi 2 trang 94 Hóa học 10: Cho phản ứng của các chất ở thể khí:
Lời giải:
Biểu thức tính tốc độ trung bình theo sự biến đổi nồng độ chất đầu và chất sản phẩm của phản ứng trên là:
III. Các yếu tố ảnh hưởng đến tốc độ phản ứng
Hoạt động trang 95 Hóa học 10: Nghiên cứu ảnh hưởng của nồng độ đến tốc độ phản ứng:
Na2S2O3 + H2SO4 → Na2SO4 + S + SO2 + H2O
- Rót nhanh vào mỗi bình 30 mL dung dịch H2SO4 0,5 M và bắt đầu bấm giờ.
Hình 19.3 Thí nghiệm nghiên cứu ảnh hưởng của nồng độ đến tốc độ phản ứng
1. Phản ứng ở bình nào xảy ra nhanh nhất? Chậm nhất?
2. Nồng độ ảnh hưởng thế nào đến tốc độ phản ứng?
Lời giải:
1. Phản ứng ở bình chứa dung dịch Na2S2O3 có nồng độ 0,3M xảy ra nhanh nhất.
Phản ứng ở bình chứa dung dịch Na2S2O3 có nồng độ 0,05M xảy ra chậm nhất.
2. Ảnh hưởng của nồng độ đến tốc độ phản ứng: Khi nồng độ các chất tham gia tăng, tốc độ phản ứng tăng.
Câu hỏi 3 trang 96 Hóa học 10: Cho phản ứng: X + Y → XY
a) Hãy viết phương trình tốc độ của phản ứng này.
– Tại thời điểm đã hết một nửa lượng X.
Lời giải:
a) Phương trình tốc độ của phản ứng: v = k.CX.CY
b) Tốc độ phản ứng tại thời điểm đầu là:
v = 2,5.10-4.0,02.0,03 = 1,5.10-7 (mol/(L.s))
- Tại thời điểm đã hết một nửa lượng X
⇒ Nồng độ X còn 0,01M và đã phản ứng 0,01M
⇒ Theo phương trình, nồng độ Y phản ứng là 0,01M
⇒ Tại thời điểm xét, nồng độ Y còn 0,03M – 0,01M = 0,02M
⇒ v = 2,5.10-4.0,01.0,02 = 5.10-8 (mol/(L.s))
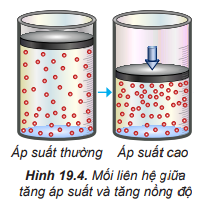
Câu hỏi 4 trang 97 Hóa học 10: Nêu mối liên hệ giữa nồng độ và áp suất của khí trong hỗn hợp.
Lời giải:
Trong hỗn hợp khí, nồng độ mỗi khí tỉ lệ thuận với áp suất của nó. Khi nén hỗn hợp khí (giảm thể tích) thì nồng độ mỗi khí tăng lên và ngược lại.
Câu hỏi 5 trang 97 Hóa học 10: Áp suất ảnh hưởng đến tốc độ phản ứng nào sau đây?
CO2(g) + Ca(OH)2(aq) ⟶ CaCO3(s) + H2O (l) (2)
SiO2(s) + CaO(s) ⟶ CaSiO3(s) (3)
BaCl2(aq) + H2SO4(aq) ⟶ BaSO4(s) + 2HCl(aq) (4)
Lời giải:
Chú ý: Việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng không có chất khí tham gia.
Xét phản ứng (1), (2) có sự tham gia của chất khí (g) ⇒ Áp suất ảnh hưởng đến tốc độ phản ứng.
Xét phản ứng (3), (4) không có sự tham gia của chất khí (g) ⇒ Áp suất không ảnh hưởng đến tốc độ phản ứng.
Chuẩn bị: Mg dạng phoi bào, dung dịch phenolphthalein, nước cất, 2 ống nghiệm, đèn cồn, kẹp gỗ.
- Cho vào mỗi ống nghiệm khoảng 3 mL nước cất.
- Nhỏ vào mỗi ống nghiệm 1 – 2 giọt phenolphthalein và cho vào mỗi ống 1 mẫu phoi bào Mg.
Lưu ý: Làm sạch bề mặt Mg trước khi tiến hành thí nghiệm.
1. Sự thay đổi màu sắc trong ống nghiệm nào nhanh hơn?
2. Nhiệt độ ảnh hưởng như thế nào đến tốc độ phản ứng?
Lời giải:
1. Ống nghiệm được đun nóng, màu của dung dịch chuyển sang màu hồng nhanh hơn.
2. Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
Câu hỏi 6 trang 98 Hóa học 10: Hãy giải thích tại sao khi nhiệt độ tăng thì tốc độ phản ứng tăng.
Lời giải:
Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
Câu hỏi 7 trang 98 Hóa học 10: Nêu ý nghĩa của hệ số nhiệt độ Van't Hoff.
Lời giải:
Ta có biểu thức:
Trong đó, γ là hệ số nhiệt độ Van’t Hoff, vT là tốc độ phản ứng tại nhiệt độ T, vT+10 là tốc độ phản ứng tại nhiệt độ T +10.
⇒ Ý nghĩa: Hệ số nhiệt độ cho biết khi nhiệt độ tăng lên 10oC thì tốc độ phản ứng tăng bao nhiêu lần. Giá trị của γ càng lớn thì ảnh hưởng của nhiệt độ đến tốc độ phản ứng càng mạnh.
a) Hãy tính hệ số nhiệt độ Van't Hoff của phản ứng trên.
Lời giải:
a) Hệ số nhiệt độ Van't Hoff của phản ứng là
b) Ta có: = 3.0,15 = 0,45 mol/(L.min)
Hoạt động trang 98 Hóa học 10: Nghiên cứu ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Chuẩn bị: 2 bình tam giác, dung dịch HCl 0,5 M, đá vôi dạng viên, đá vôi đập nhỏ.
- Rót 20 mL dung dịch HCl 0,5 M vào mỗi bình.
Quan sát hiện tượng và thực hiện yêu cầu sau:
1. Phản ứng trong bình nào có tốc độ thoát khí nhanh hơn?
2. Đá vôi dạng nào có tổng diện tích bề mặt lớn hơn?
3. Nêu ảnh hưởng của diện tích bề mặt tiếp xúc đến tốc độ phản ứng.
Lời giải:
1. Phản ứng trong bình tam giác (2) chứa đá vôi đập nhỏ có tốc độ thoát khí nhanh hơn.
2. Đá vôi khi đập nhỏ có tổng diện tích bề mặt lớn hơn.
3. Khi tăng diện tích bề mặt tiếp xúc, số va chạm giữa các chất đầu tăng lên, số va chạm hiệu quả cũng tăng theo, dẫn đến tốc độ phản ứng tăng.
Hoạt động trang 99 Hóa học 10: Nghiên cứu ảnh hưởng của chất xúc tác đến tốc độ phản ứng:
Chuẩn bị: 2 bình tam giác, dung dịch H2O2 10%, MnO2.
- Rót vào 2 bình tam giác, mỗi bình 20 mL dung dịch H2O2 10%.
- Thêm khoảng 0,1 g xúc tác MnO2 vào một bình và lắc đều.
Quan sát hiện tượng và thực hiện yêu cầu sau:
1. So sánh tốc độ thoát khí ở hai bình.
2. Chất xúc tác ảnh hưởng thế nào đến tốc độ phản ứng?
Lời giải:
1. Bình tam giác cho xúc tác MnO2 có tốc độ thoát khí lớn hơn.
2. Chất xúc tác làm tăng tốc độ phản ứng nhưng nó không bị biến đổi về lượng và chất sau phản ứng.
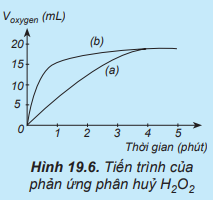
Lời giải:
Đường phản ứng (a) trên đồ thị tương ứng với phản ứng không có xúc tác.
Đường phản ứng (b) trên đồ thị tương ứng với phản ứng có xúc tác vì lượng khí oxygen thoát ra ngay từ phút đầu tiên đã nhiều hơn.
III. Một số ứng dụng của việc thay đổi tốc độ phản ứng
Lời giải:
Yếu tố được áp dụng để làm thay đổi tốc độ của các phản ứng trong Hình 19.7 là:
a) Đèn xì oxygen – acetylene: nồng độ (tăng nồng độ oxygen).
Đốt acetylene bằng oxygen nguyên chất cháy nhanh và cho nhiệt độ cao hơn khi đốt bằng oxygen trong không khí.
b) Tủ lạnh bảo quản thức ăn: nhiệt độ (hạ thấp nhiệt độ)
Nhiệt độ trong tủ lạnh thấp hơn nhiệt độ môi trường giúp phản ứng phân hủy thức ăn của các vi sinh vật diễn ra chậm hơn, thức ăn bảo quản được lâu hơn.
c) Bình dưa muối: chất xúc tác.(vi khuẩn lactic)
Phương pháp muối chua được thực hiện nhờ sự hoạt động của vi khuẩn lactic biến một phần đường thành axit lactic gây chua.
4NH3(g) +5O2(g) → 4NO(g) + 6H2O(g)
Hãy nêu một số cách để tăng tốc độ phản ứng này.
Lời giải:
Các cách để tăng tốc độ phản ứng:
- Tăng nồng độ của chất tham gia phản ứng.
- Sử dụng chất xúc tác: Platinum (Pt) ( hoặc Fe2O3, Cr2O3)
- Tăng nhiệt độ.
- Tăng áp suất của phản ứng
Chú ý: Trong phản ứng tổng hợp ammonia, ngoài yếu tố tốc độ phản ứng còn có vấn đề chuyển dịch cân bằng. Khi nhiệt độ tăng, tốc độ phản ứng tăng, nhưng cân bằng lại chuyển dịch theo chiều nghịch do đây là phản ứng tỏa nhiệt. Do đó, trong kĩ thuật, cần phải kết hợp hợp lí hai yếu tố này, tức là thực hiện phản ứng ở nhiệt độ không cao lắm (khoảng 400oC) để tốc độ phản ứng đủ nhanh và đồng thời không làm cân bằng chuyển dịch mạnh về phía chiều nghịch.
Lời giải:
Trong công nghiệp, cần sản xuất các sản phẩm với số lượng lớn, đảm bảo tiết kiệm tối đa về chi phí và thời gian. Tuy nhiên, có những chất tham gia cần năng lượng lớn để phá vỡ liên kết mới tham gia phản ứng được hoặc có những phản ứng phản ứng xảy ra chậm.
⇒ Cần tiến hành ở nhiệt độ cao và sử dụng chất xúc tác để tăng tốc độ phản ứng.
Bài viết liên quan
- Giải Hóa 10 Kết nối tri thức Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
- Giải Hóa 10 Kết nối tri thức Bài 18: Ôn tập chương 5
- Giải Hóa 10 Kết nối tri thức Bài 20: Ôn tập chương 6
- Giải Hóa 10 Kết nối tri thức Bài 21: Nhóm halogen
- Giải Hóa 10 Kết nối tri thức Bài 22: Hydrogen halide. Muối halide