Giải Hóa 10 Kết nối tri thức Bài 11: Liên kết ion
Hamchoi.vn trân trọng giới thiệu: lời giải bài tập Hóa lớp 10 Bài 11: Liên kết ion sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa 10 Bài 11. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 11: Liên kết ion
Video giải bài tập Hóa lớp 10 Bài 11: Liên kết ion
Lời giải:
NaCl là hợp chất ion được tạo thành do lực hút tĩnh điện giữa cation Na+ và anion Cl-. Các ion được sắp xếp theo một trật tự nhất định trong không gian theo kiểu mạng lưới tạo thành mạng tinh thể ion.
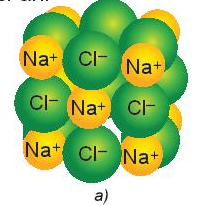
Trong tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy ở nhiệt độ cao.
Khi NaCl nóng chảy hoặc bị hòa tan trong dung dịch, các ion bị tách khỏi mạng lưới tinh thể, chuyển động tự do và là tác nhân dẫn điện.
I. Sự tạo thành ion
Câu hỏi 1 trang 52 Hóa học 10: Hoàn thành các sơ đồ tạo thành ion sau:
a) Li ⟶ Li+ + ? b) Be ⟶ ? + 2e
Lời giải:
a) Li ⟶ Li+ + 1e
b) Be ⟶ Be2+ + 2e
c) Br + 1e ⟶ Br–
d) O + 2e ⟶ O2-
Lời giải:
- Cấu hình electron của K là 1s22s22p63s23p64s1.
K ⟶ K+ + 1e
⇒ Cấu hình electron của K+ là 1s22s22p63s23p6.
⇒ Cấu hình electron của K+ giống với khí hiếm Ar.
- Cấu hình electron của Mg là 1s22s22p63s2.
Mg ⟶ Mg2+ + 2e
⇒ Cấu hình electron của Mg2+ là 1s22s22p6.
⇒ Cấu hình electron của Mg2+ giống với khí hiếm Ne.
- Cấu hình electron của F là 1s22s22p5.
F + 1e ⟶ F-
⇒ Cấu hình electron của F– là 1s22s22p6.
⇒ Cấu hình electron của F– giống với khí hiếm Ne.
- Cấu hình electron của S là 1s22s22p63s23p4.
S + 2e ⟶ S2–
⇒ Cấu hình electron của S2– là 1s22s22p63s23p6.
⇒ Cấu hình electron của S2– giống với khí hiếm Ar.
Câu hỏi 3 trang 52 Hóa học 10: Vì sao một ion O2- kết hợp được với hai ion Li+?
Lời giải:
O + 2e ⟶ O2–
Li ⟶ Li+ + 1e
Mỗi nguyên tử Li nhường 1 electron để đạt đến cấu hình bền vững giống khí hiếm và tạo thành cation Li+. Mỗi nguyên tử O cần nhận 2 electron từ 2 nguyên tử Li để đạt đến cấu hình bền vững của khí hiếm và tạo thành anion O2-.
Anion O2- hút 2 cation Li+ bằng lực hút tĩnh điện và tạo thành chất ion Li2O.
II. Sự tạo thành liên kết ion
Lời giải:
- Lực hút tĩnh điện giữa các ion mang điện trái dấu trong phân tử (hay tinh thể) tạo ra liên kết ion.
- Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình.
- Các cặp ion có thể kết hợp với nhau để tạo liên kết ion là: Na+ và O2–, Mg2+ và O2–, Na+ và Cl–, Mg2+ và Cl–.
Câu hỏi 5 trang 52 Hóa học 10: Mô tả sự tạo thành liên kết ion trong:
Lời giải:
a) Sự tạo thành liên kết ion trong calcium oxide (CaO)
Khi kim loại calcium kết hợp với phi kim oxygen, tạo thành các ion Ca2+ và O2–, các ion này có điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
Biểu diễn sự hình thành liên kết ion trong phân tử CaO như sau:
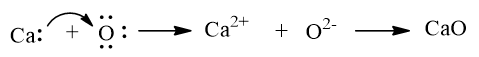
b) Sự tạo thành liên kết ion trong magnesium chloride.
Khi kim loại magnesium kết hợp với phi kim chlorine, tạo thành các ion Mg2+ và Cl–, các ion này có điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
Biểu diễn sự hình thành liên kết ion trong phân tử MgCl2 như sau:
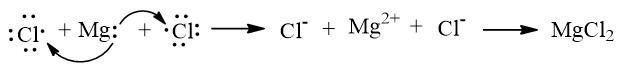
III. Tinh thể ion
Hoạt động trang 53 Hóa học 10: Lắp ráp mô hình tinh thể NaCl
Chuẩn bị: bộ mô hình tinh thể NaCl.
- Chọn hình cầu có màu sắc khác nhau đại diện cho ion Na+ và ion Cl-.
- Lắp các hình cầu và que nối theo mẫu (Hình 11.1b).
Quan sát mô hình và xác định số ion gần nhất bao quanh một ion trái dấu ở giữa mô hình
Lời giải:
- Lắp mô hình như hình sau:
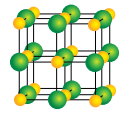
Trong đó, quả cầu quả nhỏ màu vàng đại diện cho ion Na+; quả cầu to hơn màu xanh đại diện cho ion Cl-.
- Quan sát mô hình, ta thấy: mỗi ion Na+ được bao quanh bởi 6 ion Cl- gần nhất và mỗi ion Cl- cũng được bao quanh bởi 6 ion Na+ gần nhất.
Hoạt động trang 54 Hóa học 10: Thử tính dẫn điện của hợp chất
Nếu đèn sáng thì chất dẫn điện, nếu đèn không sáng thì chất không dẫn điện.
Quan sát hiện tượng và cho biết trường hợp nào dẫn điện, trường hợp nào không dẫn điện. Giải thích.
Lời giải:
Các trường hợp dẫn điện (đèn sáng): dung dịch muối ăn bão hòa
Các trường hợp không dẫn điện (đèn không sáng): Dung dịch nước đường, muối ăn khan.
Giải thích:
- Muối ăn là hợp chất ion nên tan nhiều trong nước. Khi tan trong nước, các ion Na+ và Cl- bị tách khỏi mạng lưới tinh thể, chuyển động khá tự do và là tác nhân dẫn điện.
- Muối ăn khan tức là ở trạng thái rắn, các ion không di chuyển tự do được nên muối ăn khan không dẫn điện.
- Đường không phải hợp chất ion nên dung dịch đường không dẫn được điện.
Câu hỏi 6 trang 54 Hóa học 10: a) Vì sao muối ăn có nhiệt độ nóng chảy cao (801oC)?
b) Hợp chất ion dẫn điện trong trường hợp nào? Vì sao?
Lời giải:
a) Muối ăn là chất ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion khó nóng chảy ⇒ nhiệt độ nóng chảy cao (801oC)
b) Các hợp chất ion ở trạng thái nóng chảy hoặc dung dịch sẽ dẫn điện, vì:
- Khi nóng chảy hoặc tan trong nước, các ion bị tách khỏi mạng lưới tinh thể, chuyển động khá tự do và là tác nhân dẫn điện.
- Ở trạng thái rắn, các ion không di chuyển tự do được nên hợp chất ion không dẫn điện.
Lời giải:
- Potassium hydroxide (KOH) là hợp chất ion được tạo thành do lực hút tĩnh điện giữa cation K+ và anion OH-.
- Ở điều kiện thường KOH tồn tại ở trạng thái rắn, nhiệt độ sôi (1327oC) và nhiệt độ nóng chảy (406oC) cao.
- Potassium hydroxide (KOH) là hợp chất ion được dùng làm chất dẫn điện trong pin alkaline (pin kiềm).


