Giải Hóa 10 Kết nối tri thức Bài 22: Hydrogen halide. Muối halide
Hamchoi.vn trân trọng giới thiệu: lời giải bài tập Hóa lớp 10 Bài 22: Hydrogen halide. Muối halide sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa 10 Bài 22. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 22: Hydrogen halide. Muối halide
Lời giải:
Ứng dụng trên dựa vào tính acid của hydrochloric acid.
Hydrochloric acid có thể tác dụng được với oxide kim loại (gỉ sét), hydroxide, muối carbonate.
I. Hydrogen halide
Câu hỏi 1 trang 113 Hóa học 10: Nêu xu hướng biến đổi độ dài liên kết trong dãy HX.
Lời giải:
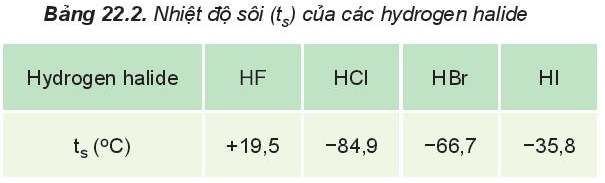
Từ F đến I bán kính nguyên tử tăng dần, độ âm điện giảm dần ⇒ Độ dài liên kết tăng dần theo dãy: HF < HCl < HBr < HI
Lời giải:
HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen:
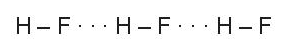
Từ HCl đến HI, nhiệt độ sôi tăng do:
- Lực tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.
II. Hydrohalic acid
Lời giải:
Để tách được vàng tinh khiết ra khỏi chất rắn gồm vàng và kẽm, ta dùng dung dịch hydrohalic acid (HCl) vì chỉ kẽm phản ứng được với HCl, vàng không phản ứng với HCl.
Sau khi phản ứng hoàn toàn, lọc thu lấy phần chất rắn đem rửa sạch và sấy khô ta thu được vàng tinh khiết.
Phương trình hóa học của phản ứng: Zn + 2HCl ⟶ ZnCl2 + H2↑
Hoạt động 1 trang 113 Hóa học 10: Dung dịch HCl tác dụng với kim loại
Chuẩn bị: 2 ống nghiệm, dung dịch HCl loãng, Zn dạng hạt, Cu dạng lá.
- Cho vào 2 ống nghiệm, mỗi ống khoảng 2 mL dung dịch HCl loãng.
- Cho vài hạt Zn vào ống (1), vài lá Cu vào ống (2).
Quan sát hiện tượng và viết phương trình hoá học.
Lời giải:
Hiện tượng:
- Ống (1): hạt Zn tan dần và có bọt khí thoát ra.
- Ống (2): không hiện tượng gì.
Phương trình hóa học:
Zn + 2HCl ⟶ ZnCl2 + H2↑
Hoạt động 2 trang 114 Hóa học 10: Dung dịch HCl tác dụng với muối NaHCO3 rắn
Chuẩn bị: dung dịch HCl loãng, muối NaHCO3 rắn, ống nghiệm.
Cho 1 thìa nhỏ NaHCO3 vào ống nghiệm, thêm tiếp dung dịch HCl loãng.
Quan sát hiện tượng và thực hiện yêu cầu sau:
1. Viết phương trình hoá học của phản ứng.
2. So sánh tính acid của HCl và H2CO3.
Lời giải:
Hiện tượng: NaHCO3 rắn tan dần, có bọt khí không màu thoát ra khỏi ống nghiệm.
1. Phương trình hóa học của phản ứng: HCl + NaHCO3 → NaCl + H2O + CO2
2. Phản ứng acid với muối tạo muối mới và acid mới có tính acid yếu hơn acid ban đầu
⇒ Tính acid của HCl mạnh hơn H2CO3
Acid H2CO3 không bền lập tức phân hủy thành CO2 và H2O
Lời giải:
Phương trình hóa học:
2HCl + Fe ⟶ FeCl2 + H2
2HCl + MgO ⟶ MgCl2 + H2O
2HCl + Cu(OH)2 ⟶ CuCl2 + 2H2O
HCl + AgNO3 ⟶ AgCl↓ + HNO3
Ứng dụng này dựa trên tính chất hoá học nào của hydrochloric acid?
Lời giải:
Ứng dụng trên dựa trên tính acid mạnh của hydrochloric acid. Hydrochloric acid hòa tan được lớp oxide, hydroxide, muối carbonate.
III. Muối halide
Hoạt động trang 115 Hóa học 10: Nhận biết ion halide
Chuẩn bị: 4 ống nghiệm; các dung dịch: AgNO3, NaF, NaCl, NaBr, NaI.
- Cho 2 mL mỗi dung dịch NaF, NaCl, NaBr, NaI vào từng ống nghiệm.
- Nhỏ vài giọt dung dịch AgNO3 vào mỗi ống nghiệm.
Quan sát hiện tượng và thực hiện yêu cầu sau:
1. Viết phương trình hóa học các phản ứng xảy ra.
2. Nêu cách nhận biết dung dịch muối halide bằng dung dịch AgNO3.
Lời giải:
1. Phương trình hóa học:
AgNO3 + NaCl ⟶ AgCl↓ trắng + NaNO3
AgNO3 + NaBr ⟶ AgBr↓ vàng nhạt + NaNO3
AgNO3 + NaI ⟶ AgI↓vàng đậm + NaNO3
2. Cách nhận biết
- Ống nghiệm xuất hiện kết tủa trắng ⇒ Ống nghiệm đó chứa NaCl.
- Ống nghiệm xuất hiện kết tủa màu vàng nhạt ⇒ Ống nghiệm đó chứa NaBr.
- Ống nghiệm xuất hiện kết tủa màu vàng đậm ⇒ Ống nghiệm đó chứa NaI.
- Ống nghiệm không hiện tượng ⇒ Ống nghiệm đó chứa NaF.
Lời giải:
Trong phản ứng với sulfuric acid đặc, NaBr và NaI đóng vai trò là chất khử.
Phương trình hóa học:
Câu hỏi 7 trang 116 Hóa học 10: Vì sao không dùng trực tiếp nước biển làm nước uống, nước tưới cây?
Lời giải:
Không dùng trực tiếp nước biển làm nước uống vì:
- Đa phần nước biển trên thế giới có nồng độ dao động từ 3,1 - 3,5%.
- Mặt khác, thận người chỉ có thể điều tiết lượng muối trong cơ thể ở mức 0,9%, nếu bổ sung thêm nước biển, nó sẽ khiến thận phải làm việc nhiều hơn gấp bội, vượt quá giới hạn tối đa công suất làm việc của thận. Bên cạnh đó chúng ta mất nhiều nước hơn để thải chính lượng muối đó ra ngoài.
- Thực tế, trong nước biển ngoài NaCl thì còn chứa 1 số tạp chất khác.
Không dùng trực tiếp nước biển làm nước tưới cây vì:
- Bản thân các loại cây trồng rất khó có thể thải hết lượng muối lớn trong cây ra bên ngoài. Vì vậy mới có hiện tượng hàm lượng muối trong dung dịch của các loại cây trồng cao hơn hàm lượng muối bên ngoài, dẫn đến lượng nước trong các loại cây trồng liên tục thẩm thấu ra ngoài, làm mất các chất dinh dưỡng, gây vàng lá, khô thân, cuối cùng là các cây trồng bị chết do thiếu nước.
a) Loại nào cần vô trùng tuyệt đối và phải dùng theo chỉ định của bác sĩ?
b) Để pha 1 lít nước muối sinh lí NaCl 0,9% dùng làm nước súc miệng thì cần bao nhiêu gam muối ăn?
Lời giải:
a) - Loại nước muối sinh lí dùng để tiêm vào tĩnh mạch cần vô trùng tuyệt đối và phải dùng theo chỉ dẫn của bác sĩ vì khi tiêm vào tĩnh mạch thì nước muối trực tiếp đi vào máu và đi khắp cơ thể, nếu không vô trùng tuyệt đối sẽ làm cơ thể bị nhiễm khuẩn, nhiễm virus, rất nguy hiểm.
- Còn nước muối để nhỏ mắt, nhỏ mũi, súc miệng, rửa vết thương thường để loại bỏ chất bẩn trên bề mặt nên không cần vô trùng tuyệt đối.
b) Nước muối (natri clorid) được pha chế với tỷ lệ 0,9%
1 lít nước cất tương đương với 1 kg nước cất
⇔ m muối ăn = 0,009 kg = 9 gam
Vậy để pha 1 lít nước muối sinh lí NaCl 0,9% dùng làm nước súc miệng thì cần khoảng 9 gam muối ăn.
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài viết liên quan
- Giải Hóa 10 Kết nối tri thức Bài 20: Ôn tập chương 6
- Giải Hóa 10 Kết nối tri thức Bài 21: Nhóm halogen
- Giải Hóa 10 Kết nối tri thức Bài 23: Ôn tập chương 7
- Hóa học là một trong các nội dung của môn Khoa học tự nhiên ở cấp Trung học cơ sở
- Đối tượng nghiên cứu của hóa học là sự biến đổi chất, hãy lấy 5 ví dụ về sự biến đổi hóa học