Giải Hóa 10 Kết nối tri thức Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
Hamchoi.vn trân trọng giới thiệu: lời giải bài tập Hóa lớp 10 Bài 17: Biến thiên enthalpy trong các phản ứng hóa học sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa 10 Bài 17. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
Lời giải:
Phản ứng giữa đường glucose với oxygen tạo ra carbon dioxide, hơi nước là phản ứng tỏa nhiệt. Năng lượng tạo ra dưới dạng nhiệt của phản ứng này cung cấp cho cơ thể, giúp cơ thể hoạt động hiệu quả và ta cảm thấy khỏe hơn.
I. Phản ứng tỏa nhiệt, phản ứng thu nhiệt
Em hãy dự đoán phản ứng này toả nhiệt hay thu nhiệt.
Lời giải:
Phản ứng này là phản ứng thu nhiệt vì cần cung cấp nhiệt độ để sự phân hủy KMnO4 xảy ra, nếu ngừng đun nóng thì phản ứng dừng lại.
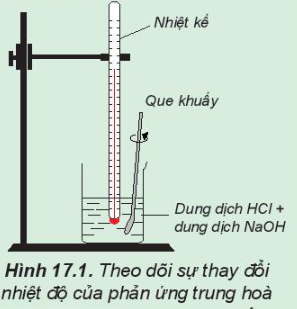
Hoạt động trang 82 Hóa học 10: Theo dõi sự thay đổi nhiệt độ của phản ứng trung hoà
- Dùng ống đong khác lấy 50 mL dung dịch NaOH 0,5 M cho vào cốc phản ứng. Khuấy nhẹ.
Theo dõi sự thay đổi nhiệt độ của dung dịch và trả lời câu hỏi:
Lời giải:
1. Sau khi rót dung dịch NaOH vào cốc thì nhiệt độ trên nhiệt kế tăng dần.
HCl + NaOH → NaCl + H2O
⇒ Phản ứng tỏa nhiệt.
2. Nếu thay các dung dịch HCl và NaOH bằng các dung dịch loãng hơn thì nhiệt độ tăng chậm hơn.
II. Biến thiên enthalpy của phản ứng
Câu hỏi 2 trang 83 Hóa học 10: Cho các phương trình nhiệt hoá học:
(1) CaCO3(s) → CaO(s) + CO2(g)
(3) Fe2O3(s) + 2Al(s) → Al2O3(s) + 2Fe(s)
Trong các phản ứng trên, phản ứng nào toả nhiệt, phản ứng nào thu nhiệt?
Lời giải:
> 0 ⇒ Phản ứng thu nhiệt.
⇒ Phản ứng thu nhiệt: (1)
< 0 ⇒ Phản ứng tỏa nhiệt.
⇒ Phản ứng tỏa nhiệt: (2), (3).
Câu hỏi 3 trang 83 Hóa học 10: Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau:
Ở điều kiện chuẩn, nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng toả ra là bao nhiêu?
Lời giải:
1 mol khí ở điều kiện chuẩn tương đương 24,79 L
Phản ứng đốt cháy 1 mol hay 24,79L khí carbon monoxide (CO) tỏa ra nhiệt lượng là 283,0kJ.
⇒ Nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng toả ra là:
Lời giải:
Một số biện pháp để đảm bảo an toàn khi thực hiện quá trình tôi vôi:
- Mặc đồ bảo hộ (quần áo, đi giày kín, đeo kính bảo hộ, đeo khẩu trang) khi thực hiện quá trình tôi vôi.
- Làm rào chắn, biển báo để cảnh báo những người không liên quan tránh xa hố vôi tôi.
- Cởi bỏ quần áo, vệ sinh sạch sẽ khi kết thúc quá trình tôi vôi.
III. Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
Câu hỏi 5 trang 86 Hóa học 10: Cho phản ứng:
a) Ở điều kiện chuẩn, kim cương hay graphite có mức năng lượng thấp hơn?
Lời giải:
a) C (kim cương) ⟶ C (graphite)
⇒ = (graphite) - (kim cương) < 0
⇒ (graphite) < (kim cương)
⇒ Dạng graphite có mức năng lượng thấp hơn kim cương.
⇒ Graphite bền vững hơn.
b) Trong phản ứng xác định nhiệt tạo thành của CO2(g): C(s) + O2(g) → CO2(g).
Nhiệt tạo thành của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất, ở một điều kiện xác định
⇒ Trong phản ứng xác định nhiệt tạo thành của CO2(g) carbon ở dạng graphite vì graphite là dạng bền vững hơn.
C2H6 (g) + O2 (g) 2CO2 (g) + 3H2O (l) (1)
Lời giải:
Tổng nhiệt tạo thành các chất đầu là:
= (-84,7.1) + 0.= - 84,7 (kJ)
Tổng nhiệt tạo thành các chất sản phẩm là:
= (-393,5.2) + (-285,8.3) = - 1644,4 (kJ)
⇒ Biến thiên enthalpy của phản ứng:
= - 1559,7 (kJ)
IV. Tính biến thiên enthalpy của phản ứng theo liên kết năng lượng liên kết
b) Giải thích vì sao nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện.
Lời giải:
a)
= [945.1 + 494.1] – 607.2 = 225 (kJ)
b) = 225 kJ > 0 ⇒ Phản ứng thu nhiệt.
Tức là 1 mol N2 (g) phản ứng với 1 mol O2 (g) cần cung cấp 225kJ nhiệt lượng
⇒ Nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện.
Lời giải:
Phương trình hóa học:
C4H10 (g) + O2 (g) 4CO2 (g) + 5H2O (g)
= 3.Eb (C – C) + 10.Eb (C – H) + .Eb (O = O)
= 3.346 + 10.418 + .494 = 8429 kJ
= 8.Eb (C = O) + 10.Eb (O – H) = 8.732 + 10.459 = 10446 kJ
Biến thiên enthalpy của phản ứng đốt cháy butane là:
= 8429 – 10446 = -2017 kJ.