Giải Hóa 10 Kết nối tri thức Bài 10: Quy tắc octet
Hamchoi.vn trân trọng giới thiệu: lời giải bài tập Hóa lớp 10 Bài 10: Quy tắc octet sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa 10 Bài 10. Mời các bạn đón xem:
Giải bài tập Hóa lớp 10 Bài 10: Quy tắc octet
Video giải bài tập Hóa lớp 10 Bài 10: Quy tắc octet
Lời giải:
Yếu tố quyết định đến tỉ lệ số nguyên tử của mỗi nguyên tố trong phân tử đó là tỉ lệ số electron nhường, nhận hay góp chung của nguyên tử khi tham gia liên kết để hình thành phân tử.
I. Khái niệm liên kết hóa học
Lời giải:
Cấu hình electron của nguyên tử fluorine là 1s22s22p5.
Khi nguyên tử fluorine nhận thêm 1 electron thì cấu hình electron là 1s22s22p6
⇒ Giống với khí hiếm Ne.
Lời giải:
Để giảm năng lượng, các nguyên tử kết hợp lại thành phân tử theo xu hướng đạt tới cấu hình electron bền vững của khí hiếm.
II. Quy tắc octet
Lời giải:
- Sự hình thành liên kết trong phân tử F2
Khi hình thành liên kết hóa học trong phân tử F2, nguyên tử fluorine có 7 electron hóa trị, mỗi nguyên tử fluorine cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung 1 electron.
Phân tử Fe được biểu diễn 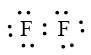
Xung quanh mỗi nguyên tử fluorine đều có 8 electron.
- Sự hình thành liên kết hóa học trong phân tử CCl4
Nguyên tử C có 4 electron hóa trị, nguyên tử Cl có 7 electron hóa trị. Mỗi nguyên tử Cl cần thêm 1 electron và nguyên tử C cần thêm 4 electron để đạt cấu hình electron bão hòa theo quy tắc octet.
Phân tử CCl4 được biểu diễn 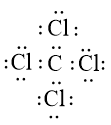
Xung quanh mỗi nguyên tử C và Cl đều có 8 electron.
- Sự hình thành liên kết hóa học trong phân tử NF3
Nguyên tử N có 5 electron hóa trị, nguyên tử F có 7 electron hóa trị. Mỗi nguyên tử F cần thêm 1 electron và nguyên tử N cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet.
Phân tử NF3 được biểu diễn 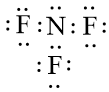
Xung quanh mỗi nguyên tử N và F đều có 8 electron.
Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hoá học trong phosphine.
Lời giải:
Sự hình thành liên kết hóa học trong phosphine:
Khi hình thành liên kết hóa học trong phân tử PH3, nguyên tử H có 1 electron hóa trị, nguyên tử P có 5 electron hóa trị. Mỗi nguyên tử H cần thêm 1 electron và nguyên tử P cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet.
Phân tử PH3 được biểu diễn như sau: 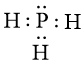
Xung quanh nguyên tử P có 8 electron.
Lời giải:
Ví dụ: Sự hình thành liên kết hóa học trong phân tử nitrogen (N2)
Khi hình thành liên kết hóa học trong phân tử N2, nguyên tử N có 5 electron hóa trị, mỗi nguyên tử N cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử N góp chung 3 electron
Phân tử N2 được biểu diễn ![]()
Bài viết liên quan
- Giải Hóa 10 Kết nối tri thức Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Giải Hóa 10 Kết nối tri thức Bài 9: Ôn tập chương 2
- Giải Hóa 10 Kết nối tri thức Bài 11: Liên kết ion
- Giải Hóa 10 Kết nối tri thức Bài 12: Liên kết cộng hóa trị
- Giải Hóa 10 Kết nối tri thức Bài 13: Liên kết hydrogen và tương tác Van der waals
