Silicon được sử dụng trong nhiều ngành công nghiệp: gốm, men sứ, thủy tinh, luyện thép, vật liệu bán dẫn
Giải Hóa 10 Bài 3 - Kết nối tri thức: Cấu trúc lớp vỏ electron nguyên tử
Câu hỏi 8 trang 25 Hóa học 10: Silicon được sử dụng trong nhiều ngành công nghiệp: gốm, men sứ, thủy tinh, luyện thép, vật liệu bán dẫn, … Hãy biểu diễn cấu hình electron của nguyên tử silicon (Z = 14) theo ô orbital, chỉ rõ việc áp dụng các nguyên lí vững bền, nguyên lí Pauli và quy tắc Hund.
Lời giải:
Ta có: Z = 14 ⇒ Nguyên tử silicon có 14 electron.
- Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng:
1s 2s 2p 3s 3p 4s …
- Điền các electron vào các phân lớp electron theo nguyên lí vững bền cho đến electron cuối cùng
1s22s22p63s23p2.
⇒ Cấu hình electron của nguyên tử silicon có Z = 14: 1s22s22p63s23p2, được biểu diễn theo ô orbital là:
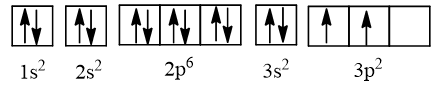
Lưu ý:
- Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s ...
- Nguyên lí Pauli: Các phân lớp 1s, 2s, 2p, 3s đều chứa tối đa các electron nên trong mỗi AO có 2 electron (kí hiệu ↑, ↓) có chiều quay ngược nhau được viết là ↑↓.
- Quy tắc Hund: Phân lớp 3p chỉ có 2 electron nên các electron phải phân bố sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau (↑).
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Mở đầu trang 21 Hóa học 10: Trong nguyên tử các electron chuyển động như thế nào?...
Câu hỏi 2 trang 22 Hóa học 10: Orbital s có dạng...
Câu hỏi 4 trang 23 Hóa học 10: Hãy cho biết tổng số electron tối đa chứa trong...
Câu hỏi 5 trang 23 Hóa học 10: Lớp electron có số electron tối đa gọi là lớp electron bão hòa...
Câu hỏi 6 trang 24 Hóa học 10: Cấu hình electron của nguyên tử có Z = 16 là...
Bài viết liên quan
- Cấu hình electron của nguyên tử có Z = 16 là
- Biểu diễn cấu hình electron của các nguyên tử có Z = 8 và Z = 11 theo ô orbital
- Chlorine (Z = 17) thường được sử dụng để khử trùng nước máy trong sinh hoạt
- Viết được cấu hình electron nguyên tử của một số nguyên tố hóa học quen thuộc trong thực tế như: nitrogen, oxygen, aluminium
- Số proton, neutron và electron của K lần lượt là
