Nguyên tử halogen có thể nhận 1 electron từ nguyên tử kim loại hoặc góp chung electron với nguyên tử phi kim
Giải Hóa 10 Bài 21 - Kết nối tri thức: Nhóm halogen
Câu hỏi 3 trang 106 Hóa học 10: Nguyên tử halogen có thể nhận 1 electron từ nguyên tử kim loại hoặc góp chung electron với nguyên tử phi kim.
Mô tả sự hình thành liên kết trong phân tử NaCl và HCl để minh hoạ.
Lời giải:
Sự hình thành liên kết trong phân tử NaCl
Nguyên tử sodium có 1 electron ở lớp ngoài cùng. Nếu mất đi 1 electron nguyên tử sodium sẽ tạo thành hạt mang điện dương, có cấu hình electron bền vững, giống với khí hiếm.
Viết gọn: Na → Na+ + 1e
Nguyên tử chlorine có 7 electron ở lớp ngoài cùng nhận 1 electron từ nguyên tử sodium. Khi nhận vào 1 electron nguyên tử chlorine sẽ tạo thành hạt mang điện âm, có cấu hình electron bền vững giống khí hiếm.
Viết gọn: Cl + 1e → Cl-
Các ion tạo thành Na+; Cl- có điện tích trái dấu hút nhau tạo nên phân tử NaCl.
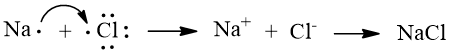
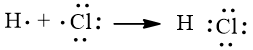
Sự hình thành liên kết trong phân tử HCl
Nguyên tử hydrogen liên kết với nguyên tử chlorine bằng cách mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl. Khi đó nguyên tử hydrogen có 2 electron (cấu hình electron bền vững của nguyên tử khí hiếm He) và nguyên tử chlorine có 8 electron lớp ngoài cùng, thoả mãn quy tắc octet.
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Câu hỏi 1 trang 105 Hóa học 10: Kể tên một số hợp chất phổ biến của halogen trong tự nhiên....
Hoạt động 2 trang 105 Hóa học 10: Tham khảo Bài 12 (Liên kết cộng hoá trị), hãy...
Câu hỏi 2 trang 106 Hóa học 10: Trong tự nhiên, các nguyên tố halogen tồn tại ở dạng hợp chất...
Câu hỏi 4 trang 107 Hóa học 10: Từ Bảng 21.2, nhận xét xu hướng biến đổi nhiệt độ nóng chảy...
Câu hỏi 6 trang 109 Hóa học 10: Một nhà máy nước sử dụng 5 mg Cl2 để khử trùng 1 L nước sinh hoạt...
Hoạt động trang 109 Hóa học 10: Tìm hiểu tính tẩy màu của khí chlorine ẩm...
Hoạt động trang 110 Hóa học 10: Phản ứng thế của một số muối halide...
Bài viết liên quan
- Từ các số oxi hoá của chlorine, hãy giải thích tại sao Cl2 vừa có tính oxi hóa vừa có tính khử
- Trong tự nhiên, các nguyên tố halogen tồn tại ở dạng hợp chất
- Từ Bảng 21.2, nhận xét xu hướng biến đổi nhiệt độ nóng chảy
- Xác định chất oxi hoá, chất khử trong phản ứng của sodium và iron với chlorine
- Xét các phản ứng hoá học: H2(g) + X2(g) ⟶ 2HX(g) (X là các halogen)
